在醫療和無塵室環境中,不當的電纜接頭選擇會造成污染風險、法規遵從失敗和設備故障,進而造成病患安全危害、昂貴的設施停工和違反 FDA 規定,而密封性不足、材質不當和清潔性差則會導致細菌滋生、微粒污染和無菌破壞,危及關鍵的醫療照護作業。許多設備管理者在選擇既能符合嚴格醫療標準,又能維持可靠電氣效能的接頭時,都會感到相當困擾。
為醫療設備和無塵室選擇電纜接頭需要瞭解 FDA 法規、 USP Class VI1 醫療級不銹鋼或特殊聚合物結構提供生物相容性、耐化學性和平滑表面,可有效清潔和消毒,同時維持關鍵醫療應用的電氣完整性。 成功與否取決於能否在符合法規要求與運作可靠性之間取得平衡。
我曾與波士頓主要醫療中心的醫院工程師、瑞士的製藥廠以及新加坡的無塵室設施合作,瞭解到醫療級電纜接頭對於維持無菌環境和確保病患安全至關重要。讓我分享為您的醫療和無塵室應用選擇最佳接頭的關鍵知識。
目錄
是什麼讓醫用電纜接頭有別於標準接頭?
醫用電纜接頭與標準接頭不同,採用生物相容性材料,表面光滑可清潔,符合 FDA 規範,提供強化的密封性以防止污染,並提供對清潔劑和消毒製程的耐化學性,其特殊設計可消除細菌藏匿的縫隙,同時在重要的醫療環境中維持電氣效能。
瞭解這些差異至關重要,因為醫療應用有其獨特的安全和法規要求,而標準的工業用接頭無法充分滿足這些要求。
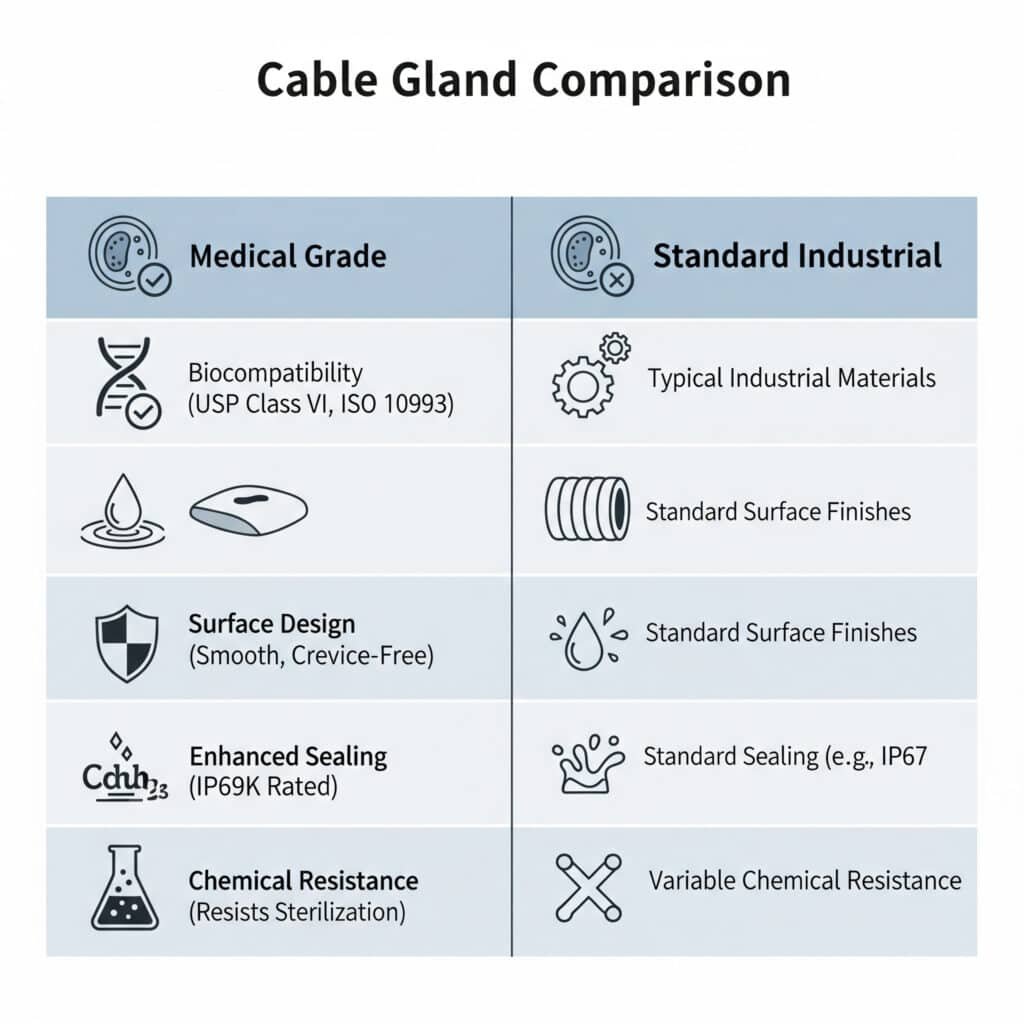
生物相容性要求
符合 USP Class VI 規範: 醫用電纜腺必須使用通過美國藥典第六類生物測試的材料,以確保醫療裝置應用的生物相容性和安全性。
ISO 10993 標準: 材料必須符合 ISO 109932 醫療器材的生物評估標準,確保不會對人體組織造成細胞毒性、致敏性或刺激性影響。
FDA 21 CFR 177 批准: 製藥和醫療設備應用通常需要符合 FDA 規範的食品級材料,以防止直接和間接與食品接觸。
生物相容性聚合物: 醫療級 PEEK、PTFE 或製藥級尼龍等專用材料可在不影響機械特性的情況下提供生物相容性。
可清潔性的表面設計
平滑表面處理: 醫用腺體具有 Ra 值通常低於 0.8 微米的超平滑表面,可防止細菌附著並有效清潔。
無縫隙設計: 消除可能滋生細菌或抵抗清潔和消毒過程的尖角、深螺紋和複雜幾何形狀。
圓邊: 所有外表面均採用圓角邊緣和平滑過渡,方便清潔,並防止損壞無塵室手套或無菌包裝。
最小表面面積: 流線型設計可在保持必要的機械和電氣性能的同時,將暴露於污染的表面面積降至最低。
增強密封性能
IP68+ 等級: 超越標準 IP68 的優異環境保護,通常可達到 IP69K 的高壓、高溫清洗應用。
污染障礙: 多重密封階段可防止微粒、細菌和清潔化學品進入,以免危害無菌環境。
耐壓性: 增強的壓力等級可承受強烈的清洗程序和消毒過程,而不會造成密封失效。
長期可靠性: 密封材料可在重複消毒週期和暴露於刺激性清潔化學品的情況下保持完整性。
耐化學性
清潔劑相容性: 耐醫院級消毒劑、季銨化合物、過氧化氫和其他侵蝕性清潔化學品。
耐滅菌: 材料可承受伽馬輻射、環氧乙烷、蒸氣高壓滅菌和其他滅菌方法而不會降解。
醫藥化學品: 耐溶劑、酸、鹼及醫療製造環境中常有的藥品化合物。
溫度穩定性: 通過消毒溫度循環和無塵室溫度控制要求保持特性。
David 是新澤西州一家大型製藥廠的設備經理,他在無菌灌裝線上面臨經常發生的污染問題,儘管採取了嚴格的清潔規範,但標準的電纜接頭仍會滋生細菌。現有的黃銅電纜接頭具有複雜的螺紋圖案和表面處理,無法進行充分的消毒,導致批次被拒絕,並影響 FDA 合規性。我們指定使用醫療級不鏽鋼電纜接頭,其表面經過電解處理,無縫隙設計符合 USP Class VI 要求。這次升級消除了污染源,達到 99.9% 的清潔效果,並幫助設施通過了 FDA 檢查,同時將產品拒收率降低了 85%。
您如何符合 FDA 和醫療器材法規?
要符合 FDA 和醫療裝置法規,必須使用具有適當認證的材料、維持詳細的文件記錄、遵循 良好生產規範 (GMP)3確保可追蹤性,並實施符合 21 CFR Part 820 的品質系統,醫用電纜接頭需要 FDA 認可的材料、生物相容性測試以及製造控制,以確保醫療裝置應用的品質與安全性一致。
在醫療應用中,法規遵循是不容妥協的,因為故障可能會導致病患傷害、產品回收,以及嚴重的法律後果。
FDA 材料要求
21 CFR Part 177: 與藥品或醫療裝置接觸的材料必須符合 FDA 對間接食品接觸物質的食品添加劑規範。
主存取檔案 (MAF): 供應商必須維護 FDA 主存取檔案,記錄材料安全、製造流程和品質控制程序。
藥物主檔案 (DMF): 對於藥品應用,材料可能需要藥物主檔案註冊,並提供詳細的成分和製造資訊。
合格證書: 供應商必須提供證書,確認材料符合所有適用的 FDA 法規和規格。
醫療器材品質標準
符合 ISO 13485 規範: 製造過程必須遵循 ISO 13485 醫療器材品質管理系統進行設計、生產和上市後監督。
21 CFR Part 820 (QSR): 符合品質系統規範,確保適當的設計控制、文件控制和矯正/預防措施。
風險管理: ISO 14971 醫療器材風險管理流程,包括風險分析、評估和控制措施。
設計控制: 正式的設計控制流程,包括設計規劃、輸入/輸出需求、審查、驗證和驗證。

文件和可追蹤性
材料證書: 完整的材料可追溯性,包括分析證書、生物相容性測試結果和法規遵循文件。
製造記錄: 詳細的製造記錄,包括製程參數、品質控制測試和批次文件,以提供完整的可追溯性。
變更控制: 針對任何影響法規遵循的材料、製程或規格修改,制定正式的變更控制程序。
供應商資格: 全面的供應商認證計畫,確保所有材料和元件符合醫療設備的要求。
驗證要求
生物相容性測試: USP Class VI 測試包括全身注射、皮內及植入測試,以驗證生物安全性。
清潔驗證: 記錄清洗程序,並提供驗證資料,證明可有效去除污染物並降低生物負荷。
滅菌驗證: 滅菌程序的驗證,包括劑量映射、無菌保證等級和材料相容性研究。
效能測試: 進行電氣、機械和環境測試,以驗證在整個產品生命週期中的性能是否符合醫療裝置的要求。
法規提交支援
510(k) 文件: 支援 FDA 510(k) 規範的技術文件,適用於包含電纜接頭的醫療裝置。
技術檔案: 適用於歐洲市場醫療器材法規 (MDR) CE 標誌的全面技術檔案。
品質協議: 與供應商簽訂正式品質協議,界定責任、規格和合規要求。
審計支援: 支援 FDA、通知機構和客戶稽核,包括文件審查和設施檢查。
無塵室應用需要哪些材料?
無塵室應用要求材料具有低放氣特性、抗微粒生成、與清潔劑的化學相容性、平滑的無孔表面,以及適當的導電性等級,其中醫療級不銹鋼 316L、PEEK、PTFE 和經無塵室認可的特殊聚合物可提供最佳性能,同時符合下列要求 ISO 146444 無塵室標準,並在受控環境中維持電氣完整性。
材料的選擇非常重要,因為無塵室需要嚴格控制可能影響產品品質或無菌條件的微粒和分子污染。
不銹鋼需求
316L 醫療等級: 奧氏體不銹鋼含碳量低,具有優異的耐腐蝕性和生物相容性,適用於醫療應用。
電解拋光處理: 電解研磨可去除表面瑕疵、減少微粒的產生,並製造平滑的表面以達到有效的清潔效果。
鈍化處理: 化學鈍化可增強耐腐蝕性,並去除可能導致變色或產生微粒的鐵污染。
表面粗糙度: Ra 值低於 0.8 微米(32 微英寸)可將細菌附著減至最低,並有助於清潔和消毒過程。
高性能聚合物
PEEK(聚醚醚酮): 優異的耐化學性、低放氣性和生物相容性,使 PEEK 成為製藥和醫療設備應用的理想選擇。
PTFE (聚四氟乙烯): 優異的化學惰性及不沾特性,提供絕佳的抗清潔化學物質及生物材料的能力。
醫療級尼龍: 特殊配方的尼龍符合美國藥典 (USP Class VI) 規範,具有良好的機械特性與生物相容性,適用於醫療應用。
通過無塵室認證的 POM: 聚甲醛具有低微粒生成和良好的尺寸穩定性,適用於精密無塵室應用。
無塵室分類相容性
ISO 5 級 (100 級): 半導體和醫藥製造應用的超平滑表面,微粒生成量極低。
ISO 6 級 (1000 級): 適用於醫療器材製造和某些製藥製程的中度微粒控制。
ISO Class 7 (Class 10000): 一般製藥和醫療設備組裝作業的標準無塵室要求。
ISO Class 8 (Class 100000): 包裝和某些醫療器材製造流程的基本無塵室要求。
除氣與污染控制
低放氣材料: 可能污染敏感製程或產品的揮發性有機化合物 (VOC) 排放量最小的材料。
分子污染: 控制可能影響產品品質的分子污染物,包括矽、塑化劑及其他有機化合物。
離子污染: 具有低離子含量的材料,可防止電子元件和藥品受到污染。
可萃取物質: 可萃取物質最少,不會在使用過程中滲入藥品或清潔溶液。
化學相容性矩陣
| 清潔劑 | 316L SS | PEEK | PTFE | 醫用尼龍 |
|---|---|---|---|---|
| 異丙醇 | 極佳 | 極佳 | 極佳 | 良好 |
| 過氧化氫 | 極佳 | 極佳 | 極佳 | 公平 |
| 季銨鹽 | 極佳 | 極佳 | 極佳 | 良好 |
| 次氯酸鈉 | 良好 | 極佳 | 極佳 | 貧窮 |
| 過乙酸 | 良好 | 極佳 | 極佳 | 貧窮 |
Hassan 是瑞士一家最先進製藥廠的營運管理人員,他需要升級 ISO 5 級無塵室中的電纜接頭,以用於無菌注射劑製造。現有的接頭在清潔週期中會產生微粒,無法承受新生物製劑產品所需的強烈消毒規範。我們提供經電解研磨的 316L 不銹鋼電纜接頭,經驗證可降低微粒產生量,並與他們的清洗和消毒流程完全化學相容。升級後,微粒計數 90% 低於 ISO 5 級限制,消除了與清洗相關的污染事件,並成功驗證了其新的無菌生產線。
如何確保適當的清洗與滅菌相容性?
要確保正確的清潔和滅菌相容性,需要選擇能夠承受重複接觸清潔化學品和滅菌方法的材料、設計出可完全清潔的表面、驗證清潔程序,以及保存詳細的文件記錄,其中醫用電纜腺體需要光滑無縫的表面、耐化學品的材料,以及達到所需無菌保證等級的驗證清潔規程。
清潔和滅菌的相容性非常重要,因為不適當的淨化會導致產品污染、病患安全風險和違反法規。
滅菌方法相容性
蒸氣高壓滅菌: 材料必須耐受 121°C-134°C 蒸氣高壓滅菌5 循環,而不會造成品質降低、尺寸改變或密封失效。
伽馬輻射: 可抵抗常用於醫療器材滅菌的 25-50 kGy 伽馬輻射劑量,而不會造成材料降解。
環氧乙烷 (ETO): 與 EtO 滅菌的化學相容性,包括對滅菌劑的耐受性和適當的脫氣特性。
過氧化氫電漿: 與低溫等離子滅菌系統相容,包括材料穩定性和滅菌劑完全滲透。
清洗驗證要求
清潔程序: 記錄清潔程序,說明有效淨化所需的化學品、濃度、接觸時間和機械動作。
驗證協議: 正式的驗證研究,利用最嚴重的污染情況和分析測試證明清洗效果。
驗收標準: 定義清潔度的驗收標準,包括目視檢查、微粒計數、生物負荷水平和化學殘留物限制。
例行監測: 持續的監控計畫,以驗證清潔效果的持續性,並確認任何性能下降的情況。
表面設計注意事項
排水功能: 設計特點可促進清潔溶液完全排出,並防止污染物積聚。
無障礙: 所有表面都必須可以使用醫療設施中使用的標準清潔工具和程序進行清潔。
拆卸要求: 請考慮是否需要拆開清洗滑蓋,或完整清洗是否足以滿足應用需求。
墊片更換: 當密封元件因暴露於清潔化學品而需要定期更換時,墊片的更換和驗證程序。
文件與合規性
清潔說明: 詳細的清潔說明,包括逐步程序、化學品規格和安全預防措施。
材料安全資料: 完整的材料安全資訊,包括化學相容性、溫度限制和消毒相容性。
驗證報告: 清洗驗證報告,證明有效性並建立例行監控要求。
訓練教材: 為設備人員提供有關正確清潔、處理和維護醫療電纜接頭程序的訓練材料。
品質控制測試
生物負荷測試: 定期進行微生物污染檢測,以驗證清潔效果並找出潛在的問題區域。
內毒素測試: 測試製藥和醫療設備應用中可能引起熱原反應的細菌內毒素。
粒子計數: 進行粒子計數測試,以驗證在清潔和維護活動之後,無塵室的要求是否得以維持。
化學殘留物分析: 測試可能污染產品或影響生物相容性的清洗化學殘留物。
不同醫療應用的主要選擇標準是什麼?
主要選擇標準依應用而異,但包括法規遵循要求、生物相容性等級、無塵室分類、消毒方法、化學曝曬和電氣性能需求,其中手術設備要求最高的生物相容性、製藥需要耐化學性質、診斷設備則注重電氣完整性,而所有應用都需要適當的法規認證和清潔相容性。
不同的醫療應用有其獨特的需求,在選擇電纜接頭時必須謹慎考慮,以確保最佳效能並符合法規要求。
手術與病患接觸設備
直接接觸要求: USP VI 級生物相容性,並針對在手術過程中直接與病患接觸的材料進行額外的細胞毒性測試。
滅菌頻率: 能夠承受頻繁的滅菌週期而不降解,通常要求材料在數百個滅菌週期中保持穩定。
電氣安全: 強化的電氣安全要求,包括低漏電電流和可靠的絕緣,適用於與病患連接的設備。
緊急可靠性: 對於失效可能直接影響病患安全的生命維持設備和緊急醫療設備的關鍵可靠性要求。
製藥
符合 GMP 規範: 良好生產規範要求,包括材料可追溯性、變更控制及驗證文件。
產品接觸安全: 不會因滲濾、微粒生成或化學作用而污染藥品的材料。
清潔驗證: 廣泛的清洗驗證要求,包含成文的製藥程序和驗收標準。
批次文件: 完成製藥設備所用材料的批次文件和可追蹤性。
診斷與實驗室設備
精度要求: 尺寸穩定、精準,適用於需要一致機械和電氣性能的分析儀器。
耐化學性: 可抵抗診斷應用中常用的實驗室化學品、試劑和清潔溶劑。
EMC 性能: 敏感分析儀器和診斷設備的電磁相容性要求。
校準穩定性: 機械穩定性不會長時間影響儀器校正或量測準確性。
醫療器材製造
製程驗證: 支援醫療器材製造過程驗證需求的材料和元件。
品質系統: 與 ISO 13485 品質系統整合,包括供應商資格認證和進料檢驗程序。
風險管理: 支援醫療器材風險管理要求的材料,包括失效模式分析和緩解策略。
法規支援: 供應商提供法規申請支援,包括技術文件和法規專業知識。
選擇決策矩陣
| 應用類型 | 主要標準 | 次要標準 | 關鍵標準 |
|---|---|---|---|
| 手術設備 | 生物相容性 | 滅菌 | USP Class VI、ISO 10993 |
| 製藥 | 耐化學性 | 符合 GMP 規範 | FDA 21 CFR、cGMP |
| 診斷 | 精確度 | EMC 性能 | IEC 61326、ISO 15189 |
| 製造業 | 製程驗證 | 品質系統 | ISO 13485、21 CFR 820 |
成本效益分析
初始成本與生命週期: 考慮整體擁有成本,包括設備使用年限內的維護、更換及合規成本。
法規風險: 平衡材料成本與法規遵循風險以及不遵循法規的潛在成本。
效能要求: 確保所選材料符合最低性能要求,而不會因規格過高而不必要地增加成本。
供應商能力: 評估供應商持續支援、文件和法規遵循協助的能力。
總結
為醫療設備和無塵室選擇電纜接頭,需要瞭解這些應用有別於標準工業用途的獨特法規、材料和性能要求。成功與否取決於生物相容性、無塵性、法規遵循和電氣性能之間的平衡。
可靠的醫用電纜接頭性能關鍵在於與瞭解醫療設備法規,並能在整個產品生命週期中提供適當材料、文件和持續支援的供應商合作。在 Bepto,我們專精於符合 FDA 要求和國際醫療設備標準的醫療級電纜接頭,提供關鍵醫療應用所需的品質保證和法規支援。
關於醫用電纜接頭的常見問題
問:醫療電纜接頭需要哪些認證?
A: 醫用電纜接頭通常需要 USP Class VI 生物相容性認證、符合 FDA 21 CFR 的材料規範,以及 ISO 13485 製造品質系統。具體要求取決於您的應用和法規管轄區。
問:一般的不鏽鋼電纜接頭可以用於醫療應用嗎?
A: 一般不銹鋼可能無法滿足醫療需求。醫療應用需要 316L 醫療級不鏽鋼,並經過電解拋光處理、生物相容性測試,以及符合法規要求的適當文件。
問:如何清潔和消毒醫用電纜腺體?
A: 遵循製造商確認的清洗程序,使用核准的清洗劑和滅菌方法。大多數的醫用腺體都支援蒸氣高壓滅菌、伽馬輻射或化學滅菌,並與適當的材料相容。
問:無塵室級與醫療級電纜接頭有何區別?
A: 醫療等級包括生物相容性要求和 FDA 合規性,而無塵室等級則著重於微粒控制和耐化學性。有些應用同時需要醫療和無塵室規格。
問: 醫用電纜腺體應該多久更換一次?
A: 更換頻率取決於滅菌週期、化學曝曬和製造商建議。通常在每 100-200 次滅菌週期後進行檢查,並根據狀況評估和驗證要求進行更換。



