Збої в стерилізації медичних виробів щорічно коштують виробникам мільйони доларів, причому 15-20% з них пов'язані з неналежною вентиляцією, яка перешкоджає належному проникненню стерилізуючого засобу. Стандартні вентиляційні пробки виходять з ладу через автоклав1 температурі 121-134°C або руйнуються під впливом стерилізація оксидом етилену (ЕТО)2 хімічних речовин, що ставить під загрозу забезпечення стерильності та дотримання нормативних вимог.
Стерилізаційні вентиляційні пробки забезпечують ефективну стерилізацію, дозволяючи парі або газу ЕТО проникати всередину, зберігаючи при цьому стерильні бар'єри після стерилізації. Мембранні вентиляційні пробки з ПТФЕ витримують температуру в автоклаві до 150°C і протистоять хімічній деградації ЕТО, забезпечуючи надійне підтримання стерильності медичних виробів, фармацевтичного обладнання та лабораторних інструментів, що вимагають валідованих процесів стерилізації.
Минулого року я працював з доктором Сарою Мітчелл, директором з якості провідного виробника медичного обладнання в Бостоні, який зіткнувся з проблемами валідації стерилізації упаковок для імплантаційних пристроїв. Їх стандартні нейлонові вентиляційні пробки плавилися під час циклів автоклаву і блокували належне проникнення пари. Після переходу на наші стерилізовані вентиляційні пробки з ПТФЕ фармацевтичного класу з підтвердженою температурною стійкістю вони досягли ефективності стерилізації 100% протягом 1 000 циклів валідації, забезпечивши відповідність вимогам FDA та безпеку пацієнтів! 🏥
Зміст
- Що таке стерилізовані вентиляційні пробки і чому вони так важливі?
- Як різні методи стерилізації впливають на матеріали вентиляційних пробок?
- Які матеріали найкраще підходять для автоклавної стерилізації?
- Які матеріали найкраще підходять для процесів стерилізації ЕТО?
- Як вибрати та перевірити стерилізаційні вентиляційні пробки?
- Поширені запитання про стерилізовані вентиляційні пробки
Що таке стерилізовані вентиляційні пробки і чому вони так важливі?
Розуміння ролі стерилізаційних вентиляційних пробок у виробництві медичних виробів і фармацевтичних препаратів має важливе значення для забезпечення стерильності та дотримання нормативних вимог.
Стерилізаційні вентиляційні заглушки - це спеціальні дихаючі вентиляційні отвори, розроблені, щоб витримувати процеси стерилізації, забезпечуючи при цьому проникнення стерилізуючого засобу і підтримуючи стерильні бар'єри. Вони забезпечують витіснення повітря під час стерилізації, запобігають утворенню вакууму під час охолодження і підтримують стерильні умови після стерилізації. Критично важливими сферами застосування є упаковка медичних виробів, фармацевтична тара, лабораторне обладнання та стерильне технологічне обладнання.
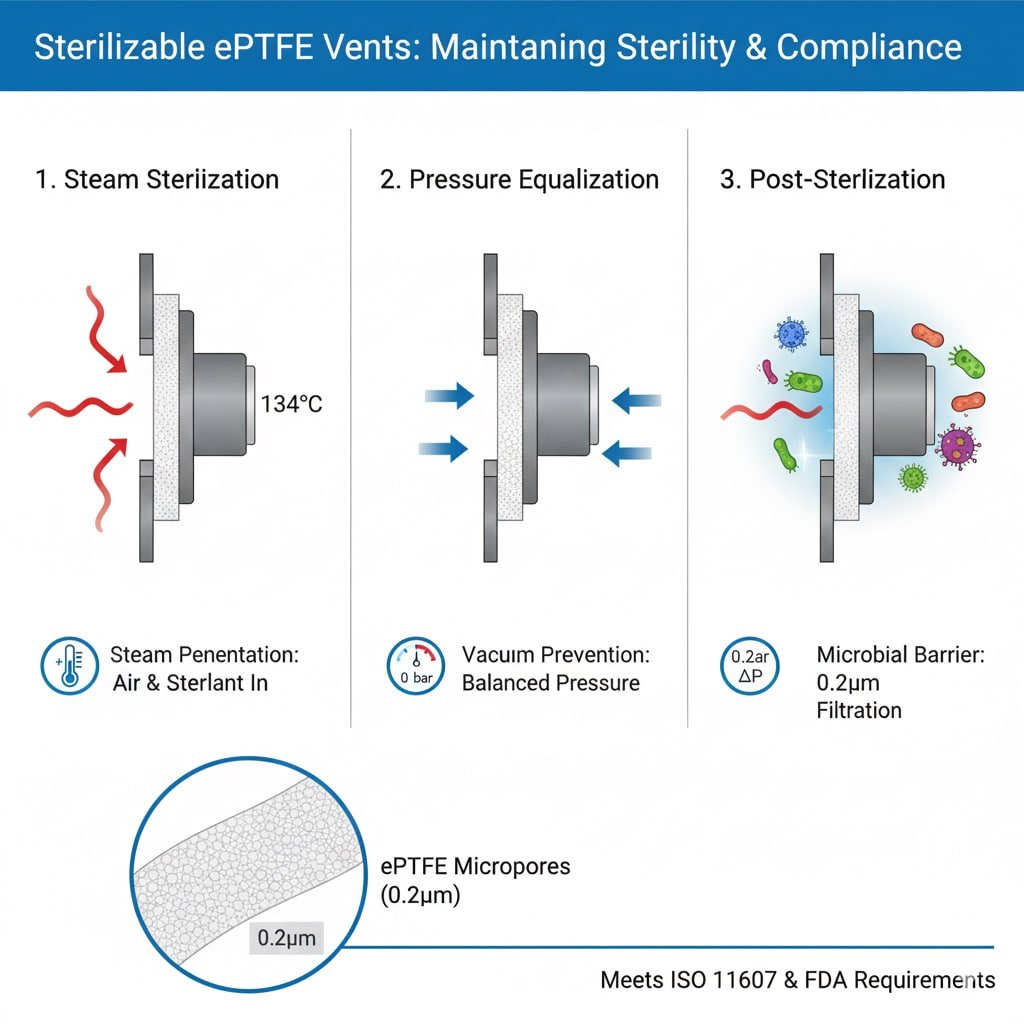
Вимоги до процесу стерилізації
Проникнення пари: Автоклавна стерилізація вимагає, щоб пара проникала в упаковку і контактувала з усіма поверхнями, що вимагає наявності вентиляційних отворів, які пропускають потік газу, зберігаючи при цьому мікробні бар'єри.
Повітряне переміщення: Ефективна стерилізація вимагає повного видалення повітря і заміни його стерилізатором, чому сприяють вентиляційні отвори з контрольованим газообміном.
Вирівнювання тиску: Цикли стерилізації створюють перепади тиску, які вентиляційні отвори повинні витримувати, не порушуючи стерильних бар'єрів і цілісності упаковки.
Критичні параметри продуктивності
Стійкість до температури: Стерилізовані вентиляційні отвори повинні зберігати структурну цілісність і ефективність фільтрації при температурі стерилізації від 121°C до 150°C.
Хімічна сумісність: Матеріали повинні протистояти руйнуванню під дією хімічних речовин для стерилізації, зокрема пари, етиленоксиду, перекису водню та озону.
Ефективність мікробного бар'єру: Після стерилізації вентиляційні отвори повинні забезпечувати надійний мікробний бар'єр3 з розміром пор, як правило, 0,2-0,22 мікрона для утримання бактерій.
Міркування щодо дотримання нормативних вимог
Вимоги до валідації FDA: Застосування медичних виробів вимагає валідованих процесів стерилізації з задокументованою ефективністю вентиляції протягом усіх циклів стерилізації.
Відповідність стандартам ISO: Стерилізовані вентиляційні отвори повинні відповідати ISO 116074 стандарти пакування та вимоги ISO 17665 щодо парової стерилізації для медичних застосувань.
Тестування на біосумісність: Медичні пристрої, що контактують з водою, можуть потребувати тестування на біосумісність класу VI USP для гарантування безпеки пацієнта.
Категорії заявок
Упаковка медичного обладнання: Стерильна упаковка для імплантатів, хірургічних інструментів та одноразових медичних виробів, які потребують підтримання стерильності до моменту використання.
Фармацевтичне виробництво: Стерильне технологічне обладнання, біореактори та фармацевтичні контейнери, що потребують валідованих процесів стерилізації.
Лабораторне обладнання: Лабораторні контейнери, що підлягають автоклавуванню, культуральне обладнання та аналітичне обладнання, що вимагає стерильних умов для отримання точних результатів.
Як різні методи стерилізації впливають на матеріали вентиляційних пробок?
Різні методи стерилізації створюють унікальні виклики для матеріалів вентиляційних пробок, вимагаючи специфічних властивостей матеріалу і конструктивних міркувань для оптимальної роботи.
Стерилізація парою піддає матеріали впливу високої температури (121-134°C) і насиченої пари, що може спричинити термічну деградацію, зміну розмірів і пошкодження мембрани. Стерилізація автоклавом піддає матеріали впливу хімічно активних речовин за нижчих температур (37-63°C), але тривалішої експозиції, що може спричинити хімічну деградацію і виділення газів. Кожен метод вимагає спеціального вибору матеріалу для забезпечення надійної роботи.
Ефекти парової стерилізації
Тепловий стрес: Високі температури спричиняють теплове розширення, можливе плавлення термопластичних компонентів і деградацію термочутливих матеріалів.
Реакції гідролізу5: Вплив пари може спричинити гідролітичну деструкцію деяких полімерів, зокрема поліефірів і деяких поліамідів.
Стабільність розмірів: Багаторазові термічні цикли можуть спричинити зміни розмірів, які впливають на ефективність ущільнення та фільтрації.
Виклики стерилізації в ЄТО
Хімічна реактивність: Оксид етилену реагує з матеріалами, що містять активні атоми водню, потенційно змінюючи властивості матеріалу і створюючи токсичні залишки.
Вимоги до дегазації: Стерилізовані ЕТО продукти потребують тривалого періоду аерації для видалення абсорбованого ЕТО та продуктів реакції перед безпечним використанням.
Характеристики проникнення: Для ефективного проникнення ETO вимагає певних умов вологості та температури, що впливає на вимоги до конструкції вентиляційного отвору.
Ефекти плазми перекису водню
Окислювальна деградація: Плазма H2O2 створює високоактивні речовини, які можуть руйнувати органічні матеріали через реакції окислення.
Сумісність матеріалів: Багато еластомерів і деякі пластмаси несумісні зі стерилізацією плазмою H2O2 через швидку деградацію.
Переваги низьких температур: Плазмова стерилізація працює при низьких температурах (45-55°C), зменшуючи термічний вплив на чутливі до температури матеріали.
Міркування щодо гамма-випромінювання
Радіаційне ураження: Високоенергетичне гамма-випромінювання може викликати розщеплення полімерного ланцюга або зшивання, що суттєво змінює властивості матеріалу.
Накопичення дози: Повторна гамма-стерилізація може спричинити кумулятивне пошкодження, що обмежує кількість циклів стерилізації, які можуть витримати матеріали.
Вимоги до антиоксидантів: Радіаційно-стійкі склади часто потребують антиоксидантів, щоб запобігти окислювальній деградації під час і після опромінення.
Нещодавно я допомагав Ахмеду Аль-Рашиду, операційному директору фармацевтичного підприємства в Дубаї, вирішити проблеми валідації стерилізації ЕТО з вентиляційними системами біореактора. Стандартні вентиляційні пробки поглинали ЕТО і вимагали тривалих 14-денних періодів аерації, що порушувало виробничі графіки. Впровадивши наші ETO-сумісні вентиляційні пробки з ПТФЕ з мінімальними характеристиками поглинання, вони скоротили час аерації до 24 годин, зберігаючи при цьому повну гарантію стерильності, що значно підвищило ефективність виробництва! 🚀
Які матеріали найкраще підходять для автоклавної стерилізації?
Вибір відповідних матеріалів для автоклавної стерилізації вимагає розуміння термічної стабільності, стійкості до гідролізу та довготривалої роботи при багаторазовому впливі пари.
PTFE (політетрафторетилен) забезпечує чудові експлуатаційні характеристики автоклава з безперервною робочою температурою до 260°C, відмінну хімічну інертність і стійкість до гідролізу. PVDF (полівініліденфторид) забезпечує хорошу термостійкість до 150°C при меншій вартості. Уникайте нейлону, стандартного поліетилену і більшості еластомерів, які розкладаються в умовах автоклава, погіршуючи ефективність фільтрації і герметизації.
Переваги ПТФЕ-мембрани
Виняткова термостійкість: PTFE зберігає структурну цілісність і ефективність фільтрації при температурах, що значно перевищують типові умови автоклаву (121-134°C).
Хімічна інертність: ПТФЕ стійкий до деградації під дією пари, хімічних засобів для чищення та побічних продуктів стерилізації, що забезпечує стабільну довготривалу роботу.
Гідрофобні властивості: Гідрофобна природа PTFE запобігає поглинанню води і зберігає стабільність розмірів протягом усіх циклів стерилізації.
Порівняння матеріальних показників ефективності
| Матеріал | Максимальна температура (°C) | Стійкість до пари | Стійкість до гідролізу | Фактор витрат |
|---|---|---|---|---|
| ПТФЕ | 260 | Чудово. | Чудово. | Високий |
| PVDF | 150 | Добре. | Добре. | Середній |
| ПП (поліпропілен) | 135 | Справедливо | Справедливо | Низький |
| Нейлон | 80-100 | Бідолаха. | Бідолаха. | Низький |
Вибір матеріалу корпусу
Нержавіюча сталь 316L: Забезпечує чудову корозійну стійкість, термічну стабільність і здатність до очищення для фармацевтичних і медичних застосувань, що вимагають затверджених процедур очищення.
PEEK (поліефірефіркетон): Пропонує виняткову термічну стабільність (безперервне використання до 250°C) з відмінною хімічною стійкістю для складних автоклавних застосувань.
Поліпропілен: Економічний варіант для одноразового використання з адекватною продуктивністю для стандартних циклів автоклавування при 121°C.
Міркування щодо компонентів ущільнення
Ущільнювальні кільця EPDM: Забезпечують хорошу паростійкість і термічну стабільність при температурах до 150°C з відмінними показниками герметизації.
Силіконові ущільнювачі: Пропонують чудову термостійкість (до 200°C), але можуть мати проблеми з сумісністю з деякими миючими засобами.
Ущільнювальні кільця з фторопласту: Поєднання хімічної стійкості ПТФЕ з ущільнювальними властивостями еластомерів для складних застосувань, де потрібні обидві експлуатаційні характеристики.
Оптимізація конструкції для використання в автоклаві
Терморозширювальне житло: Конструкції вентиляційних отворів повинні враховувати диференціальне теплове розширення матеріалів, щоб запобігти руйнуванню ущільнення під час температурних циклів.
Особливості дренажу: Правильна конструкція дренажу запобігає накопиченню конденсату, який може погіршити ефективність фільтрації або створити ризик забруднення.
Підтримка валідації: Конструктивні особливості повинні сприяти проведенню валідаційних випробувань, включаючи випробування на розпад під тиском, мікробіологічні випробування та перевірку теплових характеристик.
Які матеріали найкраще підходять для процесів стерилізації ЕТО?
ЕТО-стерилізація ставить унікальні завдання перед матеріалами, що вимагають хімічної сумісності, мінімального поглинання і швидкого газовиділення для ефективної обробки.
ПТФЕ та ПВДФ мають чудову сумісність з ЕТО з мінімальним поглинанням хімічних речовин і швидким виділенням газів. Уникайте матеріалів з активними водневими центрами, таких як нейлон, ПВХ і натуральний каучук, які реагують з ЕТО, утворюючи токсичні сполуки. Корпуси з нержавіючої сталі забезпечують оптимальну хімічну стійкість, тоді як силіконові ущільнювачі забезпечують хорошу сумісність з ЕТО з прийнятними характеристиками газовиділення для більшості застосувань.
Хімічна сумісність ETO
Механізми реакції: ЕТО реагує з матеріалами, що містять гідроксильні, аміно-, карбоксильні та сульфгідрильні групи, утворюючи похідні етиленгліколю та інші потенційно токсичні сполуки.
Характеристики поглинання: Матеріали з високим поглинанням ЕТО вимагають тривалого періоду аерації, що значно збільшує час і витрати на обробку.
Кінетика газовиділення: Матеріали, що швидко виділяють газ, дозволяють скоротити цикли аерації, підвищуючи ефективність процесу та зменшуючи час зберігання запасів.
Істотні рейтинги результативності ЄФО
Відмінна сумісність з ЕТО:
- ПТФЕ: мінімальне поглинання, швидке виділення газів, відсутність хімічної реакції
- PVDF: Низьке поглинання, хороше газовиділення, відмінна хімічна стійкість
- Нержавіюча сталь: Не вбирає вологу, можливість негайного використання
Хороша сумісність з ЄЕП:
- Поліпропілен: Помірне поглинання, прийнятне газовиділення
- Силікон: Низька реакційна здатність, помірні вимоги до газовиділення
Погана сумісність з ЄЕП:
- Нейлон: Висока реакційна здатність, необхідна тривала аерація
- ПВХ: хімічна деградація, утворення токсичних сполук
- Натуральний каучук: високе поглинання, потенційна деградація
Вимоги до часу аерації
| Матеріал | Типовий час аерації | Рівень поглинання ETO | Швидкість газовиділення |
|---|---|---|---|
| ПТФЕ | 8-24 години | Мінімальний | Рапід |
| PVDF | 24-48 годин | Низький | Добре. |
| Поліпропілен | 48-72 години | Помірний | Помірний |
| Нейлон | 7-14 днів | Високий | Повільно. |
Оптимізація параметрів процесу
Контроль температури: ЕТО-стерилізація зазвичай працює при температурі 37-63°C, що вимагає матеріалів, які зберігають продуктивність у цьому температурному діапазоні.
Вимоги до вологості: Ефективність ETO вимагає відносної вологості 40-80%, що вимагає матеріалів, які стабільно працюють в цих умовах вологості.
Управління концентрацією газу: Концентрації ЕТО 450-1200 мг/л вимагають матеріалів, які протистоять хімічному впливу, але при цьому дозволяють проникнення стерилізатора.
Міркування щодо валідації
Аналіз залишків: Стерилізовані ЕТО продукти вимагають тестування на наявність залишків ЕТО і продуктів реакції для забезпечення дотримання меж безпеки.
Забезпечення біосумісності: Матеріали повинні зберігати біосумісність після впливу ЕТО та аерації, що вимагає перевіреного вибору матеріалів.
Моніторинг процесу: ЕТО-стерилізація вимагає постійного моніторингу температури, вологості, тиску і концентрації газу протягом усього циклу.
Як вибрати та перевірити стерилізаційні вентиляційні пробки?
Правильний вибір і валідація стерилізаційних вентиляційних пробок забезпечує надійну стерилізацію, відповідність нормативним вимогам і довгостроковий успіх в експлуатації.
Відбір вимагає узгодження властивостей матеріалу з методом стерилізації, визначення вимог до експлуатаційних характеристик і врахування нормативних стандартів. Валідація включає в себе тестування термічних характеристик, дослідження мікробної активності, оцінку хімічної сумісності та оцінку довготривалої стабільності. Задокументуйте всі випробування відповідно до стандартів FDA та ISO для подання до регуляторних органів і дотримання системи якості.
Система критеріїв відбору
Сумісність з методами стерилізації: Підбирайте вентиляційні матеріали для конкретних методів стерилізації (пара, ЕТО, плазма H2O2, гамма), виходячи з вимог до температурної, хімічної та радіаційної стійкості.
Технічні характеристики: Визначте необхідну швидкість потоку, номінальний тиск, ефективність фільтрації та мікробні бар'єрні властивості, виходячи з вимог застосування.
Нормативні вимоги: Розглянемо класифікацію пристроїв FDA, відповідність стандартам ISO та вимоги до біосумісності для передбачуваного використання.
Параметри оцінки заявки
Робоче середовище: Оцініть температурні діапазони, хімічний вплив, умови тиску та ризики забруднення протягом усього життєвого циклу продукту.
Частота стерилізації: Розглянемо одноразові та багаторазові цикли стерилізації, а також кумулятивний вплив на експлуатаційні характеристики та надійність матеріалу.
Сфера валідації: Визначте вимоги до тестування на основі оцінки ризиків, регуляторного шляху та вимог системи якості.
Протокол валідаційного тестування
Тестування теплових характеристик:
- Температурний цикл в умовах стерилізації
- Вимірювання стабільності розмірів
- Перевірка ефективності фільтрації після термічного впливу
Тестування на мікробний виклик:
- Бактеріальний тест з відповідними тест-організмами
- Перевірка підтримки стерильності
- Довгострокова оцінка цілісності бар'єрів
Оцінка хімічної сумісності:
- Оцінка деградації матеріалів
- Випробування на вилучення та вилуговування
- Перевірка підтримки біосумісності
Вимоги до документації
Специфікації матеріалів: Повні технічні паспорти матеріалів, включаючи хімічний склад, термічні властивості та сертифікати відповідності.
Протоколи випробувань: Детальні протоколи валідації відповідно до рекомендацій FDA та стандартів ISO для валідації стерилізації.
Дані про продуктивність: Комплексні результати випробувань, що демонструють продуктивність у визначених умовах експлуатації та циклах стерилізації.
Інтеграція системи якості
Кваліфікація постачальника: Укладайте угоди про якість з постачальниками, включаючи простежуваність матеріалів, контроль змін та вимоги до документації з якості.
Вхідна перевірка: Розробити процедури контролю для перевірки критичних розмірів, властивостей матеріалів та експлуатаційних характеристик.
Перевірка процесу: Інтегруйте продуктивність вентиляції в загальну перевірку процесу стерилізації, включаючи тестування найгірших сценаріїв.
Міркування щодо управління ризиками
Аналіз режимів відмов: Визначте потенційні режими відмови, включаючи деградацію матеріалу, вихід з ладу ущільнень і порушення фільтрації, та розробіть відповідні стратегії пом'якшення наслідків.
Контроль змін: Встановіть процедури для управління суттєвими змінами, змінами постачальників та модифікаціями специфікацій з відповідними вимогами щодо повторної перевірки.
Постійний моніторинг: Впроваджуйте програми постійного моніторингу для перевірки безперервної продуктивності та виявлення потенційних проблем до того, як вони вплинуть на якість продукції.
Висновок
Стерилізовані вентиляційні пробки відіграють важливу роль у забезпеченні ефективної стерилізації, зберігаючи при цьому стерильні бар'єри в медичних виробах і фармацевтиці. Розуміння унікальних викликів різних методів стерилізації та вибір відповідних матеріалів має важливе значення для надійної роботи і дотримання нормативних вимог.
Заглушки для вентиляційних отворів на основі ПТФЕ демонструють чудові результати при різних методах стерилізації, забезпечуючи відмінну термостійкість, хімічну сумісність і довготривалу надійність. Правильний вибір і валідація забезпечують оптимальну ефективність стерилізації, мінімізуючи час і витрати на обробку.
Широкий асортимент стерилізованих вентиляційних пробок Bepto включає в себе мембрани з ПТФЕ фармацевтичного класу, перевірені температурні характеристики і повний пакет документації для подачі в регуляторні органи. Маючи більш ніж десятирічний досвід роботи зі спеціальними вентиляційними системами і сертифіковані за стандартом ISO виробничі потужності, ми пропонуємо надійні, економічно ефективні рішення, необхідні для критично важливих стерилізаційних застосувань. Довіртеся нам, щоб ваші процеси стерилізації були валідованими, а ваша продукція безпечною! 🔬
Поширені запитання про стерилізовані вентиляційні пробки
З: Чи можна використовувати одну й ту саму вентиляційну пробку для стерилізації в автоклаві та ЕТО?
A: Так, мембранні вентиляційні пробки з ПТФЕ ефективно справляються як з автоклавною, так і з автоклавною стерилізацією. ПТФЕ забезпечує чудову термостійкість для автоклавних циклів і мінімальне поглинання ЕТО для швидкої аерації, що робить його ідеальним для закладів, які використовують різні методи стерилізації.
З: Скільки циклів стерилізації може витримати вентиляційна пробка?
A: Високоякісні вентиляційні пробки з ПТФЕ зазвичай витримують 100+ циклів автоклавування або 50+ циклів автоклавування, зберігаючи при цьому ефективність фільтрації. Фактична тривалість циклу залежить від параметрів стерилізації, процедур поводження та критеріїв прийнятності для конкретного застосування.
З: Який розмір пор необхідний для стерильної фільтрації в медичних цілях?
A: Для надійного утримання бактерій у медичному застосуванні зазвичай потрібні пори розміром 0,2 або 0,22 мікрона. Такий розмір пор забезпечує перевірену стерильність, водночас дозволяючи достатній потік газу для ефективної стерилізації та вирівнювання тиску.
З: Чи потребують стерилізовані вентиляційні пробки спеціального валідаційного тестування?
A: Так, стерилізовані вентиляційні пробки потребують валідаційних випробувань, включаючи перевірку теплових характеристик, мікробіологічну стійкість і дослідження сумісності матеріалів. Випробування повинні відповідати рекомендаціям FDA і стандартам ISO, а також документації, що підтверджує валідацію процесу стерилізації та подання до регуляторних органів.
З: Як запобігти забрудненню вентиляційної пробки під час стерилізації?
A: Запобігайте забрудненню за допомогою правильного встановлення, захисних кришок під час роботи, перевірених параметрів стерилізації та належного зберігання після стерилізації. Використовуйте стерильну техніку під час встановлення та переконайтеся, що вентиляційні пробки призначені для вашого конкретного методу стерилізації та вимог до застосування.
-
Дізнайтеся про наукові принципи стерилізації в автоклаві та про те, як насичена пара під тиском використовується для ефективного знищення мікроорганізмів. ↩
-
Дослідіть хімічний процес стерилізації етиленоксидом (ЕТО) - низькотемпературний метод, який використовується для стерилізації термо- та вологочутливих медичних виробів. ↩
-
Дізнайтеся про методи, що використовуються для тестування та перевірки ефективності мікробного бар'єру, який запобігає проникненню мікроорганізмів і підтримує стерильність. ↩
-
Ознайомтеся з основними вимогами стандарту ISO 11607, який визначає матеріали та випробування для стерильних бар'єрних систем для медичних виробів. ↩
-
Розуміти хімічну реакцію гідролізу і те, як вона може спричинити деградацію певних полімерних матеріалів під впливом води або пари при високих температурах. ↩



