Feil ved sterilisering av medisinsk utstyr koster produsentene millioner av kroner hvert år, og 15-20% av feilene skyldes utilstrekkelig utlufting som hindrer steriliseringsmidlet i å trenge ordentlig inn. Standard ventilasjonsplugger svikter under autoklav1 temperaturer på 121-134 °C eller brytes ned når de utsettes for sterilisering med etylenoksid (ETO)2 kjemikalier, noe som går på bekostning av sterilitet og overholdelse av regelverket.
Steriliserbare ventilasjonsplugger muliggjør effektiv sterilisering ved å tillate damp- eller ETO-gassinntrengning samtidig som sterile barrierer opprettholdes etter sterilisering. Ventilasjonsåpninger med PTFE-membran tåler autoklavtemperaturer på opptil 150 °C og motstår kjemisk nedbrytning av ETO, noe som sikrer pålitelig vedlikehold av sterilitet for medisinsk utstyr, farmasøytisk utstyr og laboratorieinstrumenter som krever validerte steriliseringsprosesser.
I fjor jobbet jeg sammen med Dr. Sarah Mitchell, kvalitetsdirektør hos en ledende produsent av medisinsk utstyr i Boston, som opplevde feil i steriliseringsvalideringen av emballasjen til implanterbart utstyr. Standard ventilasjonsplugger av nylon smeltet under autoklavsykluser og blokkerte dampinntrengningen. Etter å ha byttet til våre steriliserbare PTFE-ventilasjonsplugger av farmasøytisk kvalitet med validert temperaturbestandighet, oppnådde de 100%-steriliseringseffektivitet gjennom 1 000 valideringssykluser - noe som sikrer FDA-samsvar og pasientsikkerhet! 🏥
Innholdsfortegnelse
- Hva er steriliserbare ventilasjonsplugger, og hvorfor er de så viktige?
- Hvordan påvirker ulike steriliseringsmetoder materialene i ventilasjonsplugger?
- Hvilke materialer egner seg best til autoklavsterilisering?
- Hvilke materialer fungerer best for ETO-steriliseringsprosesser?
- Hvordan velger og validerer du steriliserbare ventilasjonsplugger?
- Vanlige spørsmål om steriliserbare ventilasjonsplugger
Hva er steriliserbare ventilasjonsplugger, og hvorfor er de så viktige?
Det er viktig å forstå hvilken rolle steriliserbare ventilasjonsplugger spiller i produksjon av medisinsk utstyr og legemidler for å sikre sterilitet og etterlevelse av regelverket.
Steriliserbare ventilasjonsplugger er spesialiserte ventiler som puster, og som er utformet for å tåle steriliseringsprosesser samtidig som de tillater inntrengning av steriliseringsmiddel og opprettholder sterile barrierer. De muliggjør luftfortrengning under sterilisering, forhindrer vakuumdannelse under nedkjøling og opprettholder sterile forhold etter sterilisering. De brukes blant annet i emballasje til medisinsk utstyr, farmasøytiske beholdere, laboratorieutstyr og sterilt prosessutstyr.
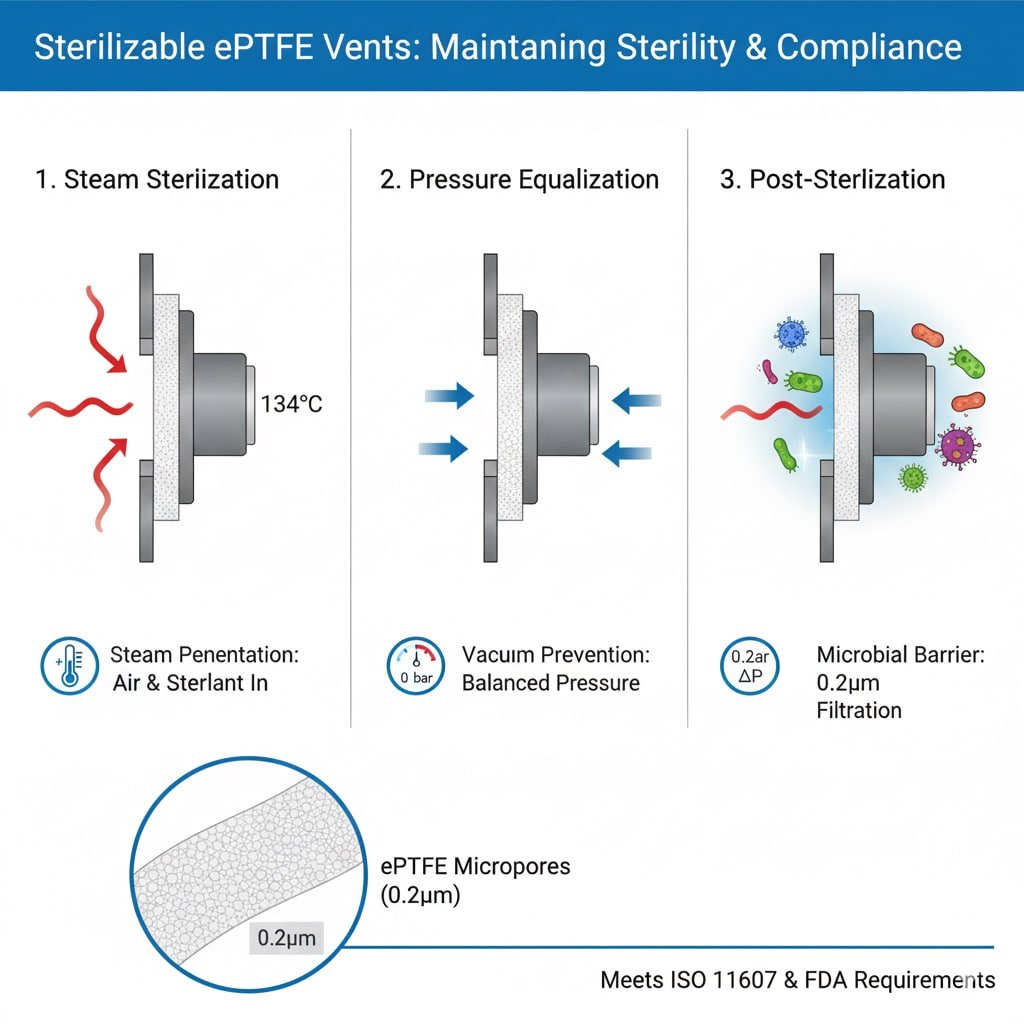
Krav til steriliseringsprosessen
Dampgjennomtrengning: Autoklavsterilisering krever at dampen trenger inn i emballasjen og kommer i kontakt med alle overflater, noe som krever ventilasjonsåpninger som tillater gassgjennomstrømning og samtidig opprettholder mikrobielle barrierer.
Luftforskyvning: Effektiv sterilisering krever fullstendig fjerning av luft og erstatning med steriliseringsmiddel, noe ventilasjonsåpninger muliggjør gjennom kontrollert gassutveksling.
Trykkutjevning: Steriliseringssykluser skaper trykkforskjeller som ventilasjonsåpningene må kunne håndtere uten at det går på bekostning av sterile barrierer eller pakningens integritet.
Kritiske ytelsesparametere
Temperaturbestandighet: Steriliserbare ventilasjonsåpninger må opprettholde strukturell integritet og filtreringsytelse ved steriliseringstemperaturer fra 121 °C til 150 °C.
Kjemisk kompatibilitet: Materialene må motstå nedbrytning fra steriliseringskjemikalier, inkludert damp, etylenoksid, hydrogenperoksid og ozon.
Mikrobiell barriereeffektivitet: Etter sterilisering må ventilasjonsåpningene gi en pålitelig mikrobiell barriere3 med porestørrelser på typisk 0,2-0,22 mikrometer for tilbakeholdelse av bakterier.
Hensyn til overholdelse av regelverk
FDAs valideringskrav: Medisinsk utstyr krever validerte steriliseringsprosesser med dokumentert ventilasjonsytelse gjennom hele steriliseringssyklusen.
Overholdelse av ISO-standarder: Steriliserbare ventilasjonsåpninger må oppfylle ISO 116074 emballasjestandarder og ISO 17665-krav til dampsterilisering for medisinsk bruk.
Testing av biokompatibilitet: Kontaktapplikasjoner for medisinsk utstyr kan kreve biokompatibilitetstesting i henhold til USP klasse VI for å sikre pasientsikkerheten.
Applikasjonskategorier
Emballasje for medisinsk utstyr: Steril emballasje for implantater, kirurgiske instrumenter og medisinsk engangsutstyr som krever at steriliteten opprettholdes frem til bruk.
Farmasøytisk produksjon: Sterilt prosessutstyr, bioreaktorer og farmasøytiske beholdere som krever validerte steriliseringsprosesser.
Laboratorieutstyr: Autoklaverbare laboratoriebeholdere, dyrkingskar og analyseutstyr som krever sterile forhold for å gi nøyaktige resultater.
Hvordan påvirker ulike steriliseringsmetoder materialene i ventilasjonsplugger?
Ulike steriliseringsmetoder skaper unike utfordringer for ventilasjonspluggmaterialer, og krever spesifikke materialegenskaper og designhensyn for optimal ytelse.
Ved dampsterilisering utsettes materialene for høy temperatur (121-134 °C) og mettet damp, noe som kan føre til termisk nedbrytning, dimensjonsendringer og membranskader. ETO-sterilisering utsetter materialene for reaktive kjemikalier ved lavere temperaturer (37-63 °C), men med lengre eksponeringstid, noe som kan føre til kjemisk nedbrytning og avgassing. Hver metode krever spesifikke materialvalg for å gi pålitelig ytelse.
Effekter av dampsterilisering
Termisk stress: Høye temperaturer fører til termisk ekspansjon, potensiell smelting av termoplastiske komponenter og nedbrytning av temperaturfølsomme materialer.
Hydrolysereaksjoner5: Eksponering for damp kan forårsake hydrolytisk nedbrytning av visse polymerer, særlig polyestere og enkelte polyamider.
Dimensjonell stabilitet: Gjentatt termisk sykling kan føre til dimensjonsendringer som påvirker tetningsevnen og filtreringseffektiviteten.
Utfordringer ved ETO-sterilisering
Kjemisk reaktivitet: Etylenoksid reagerer med materialer som inneholder aktive hydrogenatomer, noe som potensielt kan endre materialegenskapene og skape giftige rester.
Krav til avgassing: ETO-steriliserte produkter krever lengre luftingsperioder for å fjerne absorbert ETO og reaksjonsprodukter før sikker bruk.
Gjennomtrengningsegenskaper: ETO krever spesifikke fuktighets- og temperaturforhold for effektiv inntrengning, noe som påvirker kravene til ventilasjonsdesign.
Effekter av hydrogenperoksidplasma
Oksidativ nedbrytning: H2O2-plasma skaper svært reaktive arter som kan bryte ned organiske materialer gjennom oksidasjonsreaksjoner.
Materialkompatibilitet: Mange elastomerer og noen plastmaterialer er ikke kompatible med H2O2-plasmasterilisering på grunn av rask nedbrytning.
Fordeler ved lav temperatur: Plasmasterilisering foregår ved lave temperaturer (45-55 °C), noe som reduserer den termiske belastningen på temperaturfølsomme materialer.
Hensyn til gammastråling
Stråleskader: Gammastråling med høy energi kan føre til at polymerkjeder spaltes eller kryssbindes, noe som endrer materialegenskapene betydelig.
Doseakkumulering: Gjentatt gammasterilisering kan forårsake kumulativ skade, noe som begrenser antall steriliseringssykluser materialet tåler.
Behov for antioksidanter: Strålingsresistente formuleringer krever ofte antioksidanter for å forhindre oksidativ nedbrytning under og etter bestråling.
Jeg hjalp nylig Ahmed Al-Rashid, driftssjef ved et farmasøytisk anlegg i Dubai, med å løse problemer med validering av ETO-sterilisering i bioreaktorens utluftingssystem. Standard ventilasjonsplugger absorberte ETO og krevde lengre 14-dagers luftingsperioder, noe som forstyrret produksjonsplanene. Ved å implementere våre ETO-kompatible PTFE-ventilasjonsplugger med minimale absorpsjonsegenskaper, reduserte de luftingstiden til 24 timer samtidig som de opprettholdt full sterilitetssikring - og forbedret produksjonseffektiviteten dramatisk! 🚀
Hvilke materialer egner seg best til autoklavsterilisering?
For å velge egnede materialer for autoklavsterilisering må man forstå termisk stabilitet, hydrolysemotstand og langtidsytelse under gjentatt eksponering for damp.
PTFE (polytetrafluoretylen) gir overlegen autoklavytelse med kontinuerlige driftstemperaturer opp til 260 °C, utmerket kjemisk inertitet og hydrolysebestandighet. PVDF (polyvinylidenfluorid) gir god termisk stabilitet opp til 150 °C til en lavere pris. Unngå nylon, standard polyetylen og de fleste elastomerer som brytes ned under autoklavforhold, noe som går ut over filtrerings- og tetningsytelsen.
Fordeler med PTFE-membraner
Eksepsjonell temperaturbestandighet: PTFE opprettholder strukturell integritet og filtreringsytelse ved temperaturer langt over typiske autoklavbetingelser (121-134 °C).
Kjemisk inertitet: PTFE motstår nedbrytning fra damp, rengjøringskjemikalier og biprodukter fra sterilisering, noe som sikrer jevn ytelse over lang tid.
Hydrofobe egenskaper: PTFEs hydrofobe egenskaper forhindrer vannabsorpsjon og opprettholder dimensjonsstabiliteten gjennom hele steriliseringssyklusen.
Sammenligning av materialytelse
| Materiale | Maks. temperatur (°C) | Dampmotstand | Motstand mot hydrolyse | Kostnadsfaktor |
|---|---|---|---|---|
| PTFE | 260 | Utmerket | Utmerket | Høy |
| PVDF | 150 | Bra | Bra | Medium |
| PP (polypropylen) | 135 | Rimelig | Rimelig | Lav |
| Nylon | 80-100 | Dårlig | Dårlig | Lav |
Valg av husmateriale
Rustfritt stål 316L: Gir utmerket korrosjonsbestandighet, termisk stabilitet og rengjøringsvennlighet for farmasøytiske og medisinske bruksområder som krever validerte rengjøringsprosedyrer.
PEEK (polyeteretereterketon): Fremragende termisk stabilitet (kontinuerlig bruk opp til 250 °C) og utmerket kjemisk bestandighet for krevende autoklavbruk.
Polypropylen: Kostnadseffektivt alternativ for engangsbruk med tilstrekkelig ytelse for standard autoklavsykluser ved 121 °C.
Vurderinger av tetningskomponenter
EPDM O-ringer: Gir god dampmotstand og termisk stabilitet for temperaturer opp til 150 °C med utmerket tetningsytelse.
Silikonforseglinger: Overlegen temperaturbestandighet (opptil 200 °C), men kan ha kompatibilitetsproblemer med visse rengjøringskjemikalier.
PTFE-innkapslede O-ringer: Kombiner PTFEs kjemiske motstandsdyktighet med elastomertetningsegenskaper for krevende bruksområder som krever begge ytelsesegenskaper.
Designoptimalisering for bruk i autoklaver
Termisk ekspansjon Overnatting: Ventilasjonsutformingen må ta hensyn til differensial termisk ekspansjon mellom materialene for å forhindre at tetningen svikter under temperatursvingninger.
Dreneringsfunksjoner: Riktig dreneringsdesign forhindrer opphopning av kondensat som kan svekke filtreringsytelsen eller skape risiko for forurensning.
Støtte for validering: Designfunksjonene bør legge til rette for valideringstesting, inkludert trykkfall, mikrobiell utfordring og verifisering av termisk ytelse.
Hvilke materialer fungerer best for ETO-steriliseringsprosesser?
ETO-sterilisering byr på unike materialutfordringer som krever kjemisk kompatibilitet, minimal absorpsjon og rask avgassing for effektiv prosessering.
PTFE og PVDF er svært ETO-kompatible med minimal kjemisk absorpsjon og rask avgassing. Unngå materialer med aktive hydrogenområder, som nylon, PVC og naturgummi, som reagerer med ETO og danner giftige forbindelser. Hus i rustfritt stål gir optimal kjemisk motstand, mens silikontetninger gir god ETO-kompatibilitet med akseptable avgassingsegenskaper for de fleste bruksområder.
ETOs kjemiske kompatibilitet
Reaksjonsmekanismer: ETO reagerer med materialer som inneholder hydroksyl-, amino-, karboksyl- og sulfhydrylgrupper, og danner etylenglykolderivater og andre potensielt giftige forbindelser.
Absorpsjonsegenskaper: Materialer med høy ETO-absorpsjon krever lengre luftingsperioder, noe som øker behandlingstiden og kostnadene betydelig.
Kinetikk for avgassing: Materialer med rask avgassing muliggjør kortere luftingssykluser, noe som forbedrer prosesseffektiviteten og reduserer lagerholdstiden.
Rangering av materiell ETO-ytelse
Utmerket ETO-kompatibilitet:
- PTFE: Minimal absorpsjon, rask avgassing, ingen kjemisk reaktivitet
- PVDF: Lav absorpsjon, god avgassing, utmerket kjemisk motstand
- Rustfritt stål: Ingen absorpsjon, kan brukes umiddelbart
God ETO-kompatibilitet:
- Polypropylen: Moderat absorpsjon, akseptabel avgassing
- Silikon: Lav reaktivitet, moderate krav til avgassing
Dårlig ETO-kompatibilitet:
- Nylon: Høy reaktivitet, utvidet lufting kreves
- PVC: Kjemisk nedbrytning, dannelse av giftige forbindelser
- Naturgummi: Høy absorpsjon, potensiell nedbrytning
Krav til luftingstid
| Materiale | Typisk luftingstid | ETO-absorpsjonsnivå | Utgassingshastighet |
|---|---|---|---|
| PTFE | 8-24 timer | Minimal | Rask |
| PVDF | 24-48 timer | Lav | Bra |
| Polypropylen | 48-72 timer | Moderat | Moderat |
| Nylon | 7-14 dager | Høy | Sakte |
Optimalisering av prosessparametere
Temperaturkontroll: ETO-sterilisering foregår vanligvis ved 37-63 °C, noe som krever materialer som opprettholder ytelsen i hele dette temperaturområdet.
Krav til luftfuktighet: ETO-effektivitet krever 40-80% relativ luftfuktighet, noe som krever materialer som fungerer konsekvent under disse fuktighetsforholdene.
Styring av gasskonsentrasjon: ETO-konsentrasjoner på 450-1200 mg/L krever materialer som motstår kjemiske angrep, samtidig som steriliseringsmidlet kan trenge inn.
Valideringshensyn
Testing av restmengder: ETO-steriliserte produkter må testes for ETO-rester og reaksjonsprodukter for å sikre at sikkerhetsgrensene overholdes.
Vedlikehold av biokompatibilitet: Materialene må opprettholde biokompatibiliteten etter ETO-eksponering og lufting, noe som krever validert materialvalg.
Prosessovervåking: ETO-sterilisering krever kontinuerlig overvåking av temperatur, luftfuktighet, trykk og gasskonsentrasjon gjennom hele syklusen.
Hvordan velger og validerer du steriliserbare ventilasjonsplugger?
Riktig valg og validering av steriliserbare ventilasjonsplugger sikrer pålitelig steriliseringsytelse, overholdelse av forskrifter og langsiktig driftssuksess.
Ved valg av materiale må materialegenskapene tilpasses steriliseringsmetoden, ytelseskravene må defineres, og det må tas hensyn til regulatoriske standarder. Validering innebærer testing av termisk ytelse, studier av mikrobiell utfordring, vurdering av kjemisk kompatibilitet og evaluering av langtidsstabilitet. Dokumenter all testing i henhold til FDA- og ISO-standarder for innsending til myndighetene og samsvar med kvalitetssystemet.
Rammeverk for utvelgelseskriterier
Steriliseringsmetodens kompatibilitet: Tilpass ventilasjonsmaterialer til spesifikke steriliseringsmetoder (damp, ETO, H2O2-plasma, gamma) basert på krav til temperatur, kjemikalier og strålingsbestandighet.
Ytelsesspesifikasjoner: Definer nødvendige strømningshastigheter, trykkklassifiseringer, filtreringseffektivitet og mikrobielle barriereegenskaper basert på bruksområdets krav.
Regulatoriske krav: Ta hensyn til FDA-klassifisering av enheter, samsvar med ISO-standarder og krav til biokompatibilitet for tiltenkt bruk.
Parametere for vurdering av applikasjonen
Driftsmiljø: Evaluer temperaturområder, kjemisk eksponering, trykkforhold og kontamineringsrisiko gjennom hele produktets livssyklus.
Steriliseringsfrekvens: Vurder engangsbruk kontra flere steriliseringssykluser og kumulative effekter på materialets ytelse og pålitelighet.
Valideringens omfang: Fastsette testkrav basert på risikovurdering, regelverk og krav til kvalitetssystem.
Protokoll for valideringstesting
Testing av termisk ytelse:
- Temperatursykling ved steriliseringsbetingelser
- Måling av dimensjonsstabilitet
- Verifisering av filtreringseffektivitet etter termisk eksponering
Mikrobiell utfordringstest:
- Bakterieutfordring med egnede testorganismer
- Verifisering av vedlikeholdssterilitet
- Vurdering av barrierens integritet på lang sikt
Vurdering av kjemisk kompatibilitet:
- Evaluering av materialforringelse
- Testing av ekstraherbare og utvaskbare stoffer
- Verifisering av vedlikehold av biokompatibilitet
Krav til dokumentasjon
Materialspesifikasjoner: Fullstendige materialdatablad, inkludert kjemisk sammensetning, termiske egenskaper og sertifiseringer.
Testprotokoller: Detaljerte valideringsprotokoller i henhold til FDA-retningslinjer og ISO-standarder for steriliseringsvalidering.
Prestasjonsdata: Omfattende testresultater som viser ytelse gjennom spesifiserte driftsforhold og steriliseringssykluser.
Integrering av kvalitetssystemer
Kvalifisering av leverandør: Etablere kvalitetsavtaler med leverandører, inkludert krav til materialsporbarhet, endringskontroll og kvalitetsdokumentasjon.
Innkommende inspeksjon: Utvikle inspeksjonsprosedyrer for verifisering av kritiske dimensjoner, materialegenskaper og ytelsesegenskaper.
Prosessvalidering: Integrer ventilasjonsytelsen i den generelle valideringen av steriliseringsprosessen, inkludert testing av worst-case-scenarioer.
Risikostyringshensyn
Feilmodusanalyse: Identifiser potensielle feilmodi, inkludert materialforringelse, tetningssvikt og filtreringsfeil, med passende avbøtende strategier.
Change Control: Etablere prosedyrer for håndtering av materialendringer, leverandørendringer og spesifikasjonsendringer med passende krav til revalidering.
Kontinuerlig overvåking: Implementere løpende overvåkingsprogrammer for å verifisere fortsatt ytelse og identifisere potensielle problemer før de påvirker produktkvaliteten.
Konklusjon
Steriliserbare ventilasjonsplugger spiller en avgjørende rolle når det gjelder å sikre effektiv sterilisering og samtidig opprettholde sterile barrierer i medisinsk utstyr og farmasøytiske applikasjoner. Det er avgjørende å forstå de unike utfordringene ved ulike steriliseringsmetoder og velge egnede materialer for å sikre pålitelig ytelse og samsvar med regelverket.
PTFE-baserte ventilasjonsplugger gir overlegen ytelse på tvers av flere steriliseringsmetoder, med utmerket temperaturbestandighet, kjemisk kompatibilitet og langsiktig pålitelighet. Riktig valg og validering sikrer optimal steriliseringseffektivitet samtidig som behandlingstid og -kostnader minimeres.
Beptos omfattende utvalg av steriliserbare ventilasjonsplugger inkluderer PTFE-membraner av farmasøytisk kvalitet, validert temperaturytelse og komplette dokumentasjonspakker for innsending til myndighetene. Med over ti års erfaring innen spesialiserte ventilasjonsapplikasjoner og ISO-sertifisert produksjonskapasitet, tilbyr vi de pålitelige og kostnadseffektive løsningene du trenger for kritiske steriliseringsapplikasjoner. Stol på at vi sørger for at steriliseringsprosessene dine er validerte og produktene dine trygge! 🔬
Vanlige spørsmål om steriliserbare ventilasjonsplugger
Spørsmål: Kan samme ventilasjonsplugg brukes til både autoklav- og ETO-sterilisering?
A: Ja, PTFE-membranventilasjonsplugger kan håndtere både autoklav- og ETO-sterilisering effektivt. PTFE har utmerket temperaturbestandighet for autoklavsykluser og minimal ETO-absorpsjon for rask lufting, noe som gjør den ideell for anlegg som bruker flere steriliseringsmetoder.
Spørsmål: Hvor mange steriliseringssykluser tåler en ventilasjonsplugg?
A: PTFE-ventilasjonsplugger av høy kvalitet tåler vanligvis mer enn 100 autoklavsykluser eller mer enn 50 ETO-sykluser, samtidig som filtreringsytelsen opprettholdes. Faktisk sykluslevetid avhenger av steriliseringsparametere, håndteringsprosedyrer og kriterier for ytelsesaksept for din spesifikke applikasjon.
Spørsmål: Hvilken porestørrelse kreves for steril filtrering i medisinske applikasjoner?
A: Medisinske bruksområder krever vanligvis porestørrelser på 0,2 eller 0,22 mikron for pålitelig bakterieoppbevaring. Denne porestørrelsen gir validert sterilitetssikring samtidig som den tillater tilstrekkelig gasstrøm for effektiv sterilisering og trykkutjevning.
Spørsmål: Krever steriliserbare ventilasjonsplugger spesiell valideringstesting?
A: Ja, steriliserbare ventilasjonspropper krever valideringstesting, inkludert studier av termisk ytelse, mikrobiell utfordring og materialkompatibilitet. Testingen må følge FDA-retningslinjene og ISO-standardene, med dokumentasjon som støtter valideringen av steriliseringsprosessen og innsendinger til myndighetene.
Spørsmål: Hvordan forhindrer du kontaminering av ventilasjonsplugger under sterilisering?
A: Forebygg kontaminering ved hjelp av riktig installasjon, beskyttelsesdeksler under håndtering, validerte steriliseringsparametere og riktig oppbevaring etter sterilisering. Bruk steril teknikk under installasjonen, og sørg for at ventilasjonspluggene er utformet for din spesifikke steriliseringsmetode og dine krav til bruksområde.
-
Lær om de vitenskapelige prinsippene for autoklavsterilisering og hvordan mettet damp under trykk brukes til å drepe mikroorganismer på en effektiv måte. ↩
-
Utforsk den kjemiske prosessen med etylenoksidsterilisering (ETO), en lavtemperaturmetode som brukes til sterilisering av varme- og fuktsensitivt medisinsk utstyr. ↩
-
Oppdag metodene som brukes til å teste og validere effektiviteten til en mikrobiell barriere, og sikre at den forhindrer inntrengning av mikroorganismer og opprettholder steriliteten. ↩
-
Gå gjennom de viktigste kravene i ISO 11607-standarden, som spesifiserer materialer og testing for sterile barrieresystemer for medisinsk utstyr. ↩
-
Forstå den kjemiske reaksjonen hydrolyse og hvordan den kan føre til nedbrytning av visse polymermaterialer når de utsettes for vann eller damp ved høye temperaturer. ↩



