Un mauvais choix de presse-étoupe dans les environnements médicaux et les salles blanches entraîne des risques de contamination, des manquements à la conformité réglementaire et des dysfonctionnements de l'équipement qui mettent en danger la sécurité des patients, entraînent des arrêts coûteux des installations et des violations de la FDA, tandis qu'une étanchéité inadéquate, des matériaux inappropriés et une mauvaise nettoyabilité entraînent une prolifération bactérienne, une contamination particulaire et des violations de la stérilité qui compromettent les opérations de soins de santé critiques. De nombreux responsables d'établissements ont du mal à sélectionner des presse-étoupes qui répondent aux normes médicales strictes tout en conservant des performances électriques fiables.
La sélection de presse-étoupes pour les équipements médicaux et les salles blanches nécessite de comprendre les réglementations de la FDA, USP Classe VI1 La construction en acier inoxydable de qualité médicale ou en polymère spécialisé offre une biocompatibilité, une résistance chimique et des surfaces lisses pour un nettoyage et une stérilisation efficaces, tout en préservant l'intégrité électrique dans les applications de soins de santé critiques. Le succès dépend de l'équilibre entre la conformité réglementaire et la fiabilité opérationnelle.
Ayant travaillé avec des ingénieurs hospitaliers dans de grands centres médicaux à Boston, des fabricants de produits pharmaceutiques en Suisse et des salles blanches à Singapour, j'ai appris que les presse-étoupes de qualité médicale sont essentiels pour maintenir des environnements stériles et garantir la sécurité des patients. Permettez-moi de partager avec vous les connaissances essentielles pour sélectionner les presse-étoupes optimaux pour vos applications médicales et en salle blanche.
Table des matières
- Qu'est-ce qui différencie les presse-étoupes médicaux des presse-étoupes standard ?
- Comment respecter les réglementations de la FDA et des dispositifs médicaux ?
- Quels sont les matériaux requis pour les applications en salle blanche ?
- Comment s'assurer de la compatibilité avec le nettoyage et la stérilisation ?
- Quels sont les principaux critères de sélection pour les différentes applications médicales ?
- FAQ sur les presse-étoupes médicaux
Qu'est-ce qui différencie les presse-étoupes médicaux des presse-étoupes standard ?
Les presse-étoupes médicaux se distinguent des presse-étoupes standard par l'utilisation de matériaux biocompatibles, des surfaces lisses et nettoyables, la conformité aux réglementations de la FDA, une meilleure étanchéité pour la prévention de la contamination et une résistance chimique aux agents de nettoyage et aux processus de stérilisation, avec des conceptions spécialisées qui éliminent les crevasses où les bactéries pourraient se loger tout en maintenant les performances électriques dans les environnements de soins de santé critiques.
Il est essentiel de comprendre ces différences, car les applications médicales ont des exigences uniques en matière de sécurité et de réglementation que les presse-étoupes industriels standard ne peuvent pas satisfaire de manière adéquate.
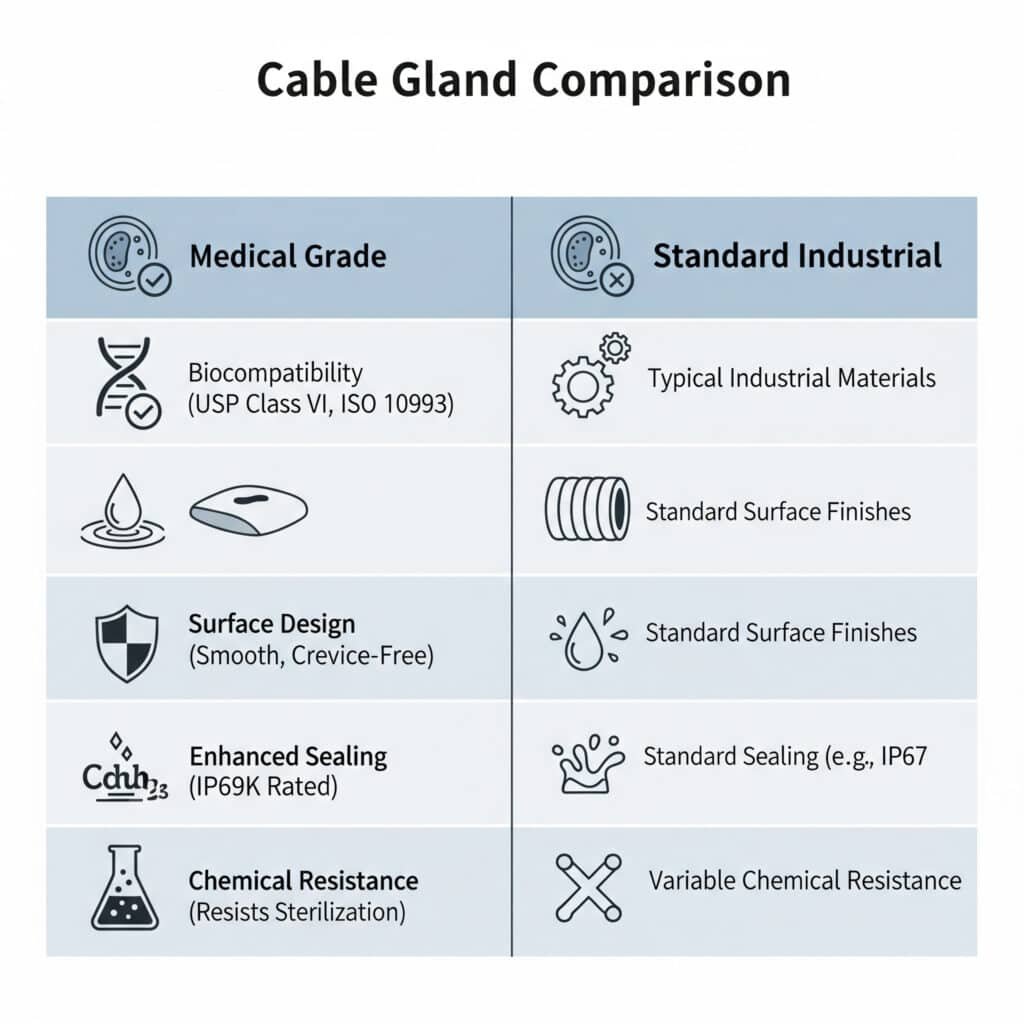
Exigences en matière de biocompatibilité
Conformité à la classe VI de l'USP : Les presse-étoupes médicaux doivent utiliser des matériaux qui satisfont aux tests biologiques de la classe VI de la pharmacopée des États-Unis en matière de biocompatibilité et de sécurité dans les applications de dispositifs médicaux.
Normes ISO 10993 : Les matériaux doivent répondre aux critères suivants ISO 109932 les normes d'évaluation biologique des dispositifs médicaux, garantissant l'absence d'effets cytotoxiques, sensibilisants ou irritants sur les tissus humains.
FDA 21 CFR 177 Approbation : Les applications pharmaceutiques et médicales exigent souvent des matériaux de qualité alimentaire conformes aux réglementations de la FDA en matière de contact direct et indirect avec les aliments.
Polymères biocompatibles : Des matériaux spécialisés tels que le PEEK de qualité médicale, le PTFE ou les nylons de qualité pharmaceutique offrent une biocompatibilité sans compromettre les propriétés mécaniques.
Conception de la surface pour la facilité de nettoyage
Lisse Finition de la surface : Les glandes médicales présentent des surfaces ultra lisses avec des valeurs Ra généralement inférieures à 0,8 micromètre afin d'empêcher l'adhésion des bactéries et de permettre un nettoyage efficace.
Conception sans crevasses : Élimination des angles vifs, des filets profonds et des géométries complexes susceptibles d'abriter des bactéries ou de résister aux processus de nettoyage et de stérilisation.
Bords arrondis : Toutes les surfaces externes présentent des bords arrondis et des transitions douces pour faciliter le nettoyage et éviter d'endommager les gants de salle blanche ou les emballages stériles.
Surface minimale : Les conceptions rationalisées minimisent la surface exposée à la contamination tout en maintenant les performances mécaniques et électriques nécessaires.
Amélioration des performances d'étanchéité
IP68+ : Protection environnementale supérieure à la norme IP68, atteignant souvent la norme IP69K pour les applications de nettoyage à haute pression et à haute température.
Barrières à la contamination : Plusieurs étapes d'étanchéité empêchent la pénétration de particules, de bactéries et de produits chimiques de nettoyage qui pourraient compromettre les environnements stériles.
Résistance à la pression : Des pressions nominales améliorées pour résister aux procédures de nettoyage agressives et aux processus de stérilisation sans défaillance du joint.
Fiabilité à long terme : Les matériaux d'étanchéité conservent leur intégrité malgré les cycles de stérilisation répétés et l'exposition à des produits chimiques de nettoyage agressifs.
Propriétés de résistance chimique
Compatibilité avec les produits de nettoyage : Résistance aux désinfectants de qualité hospitalière, aux composés d'ammonium quaternaire, au peroxyde d'hydrogène et à d'autres produits chimiques de nettoyage agressifs.
Résistance à la stérilisation : Les matériaux résistent aux rayons gamma, à l'oxyde d'éthylène, à l'autoclavage à la vapeur et à d'autres méthodes de stérilisation sans se dégrader.
Produits chimiques pharmaceutiques : Résistance aux solvants, aux acides, aux bases et aux composés pharmaceutiques couramment rencontrés dans les environnements de fabrication médicale.
Stabilité de la température : Maintenir les propriétés à travers les cycles de température de stérilisation et les exigences de contrôle de la température des salles blanches.
David, directeur d'une grande usine pharmaceutique du New Jersey, était confronté à des problèmes de contamination récurrents sur les lignes de remplissage stérile où les presse-étoupes standard abritaient des bactéries malgré des protocoles de nettoyage rigoureux. Les presse-étoupes en laiton existants présentaient des motifs de filetage et des finitions de surface complexes qui ne pouvaient pas être stérilisés de manière adéquate, ce qui entraînait des rejets de lots et des problèmes de conformité avec les normes de la FDA. Nous avons spécifié des presse-étoupes en acier inoxydable de qualité médicale avec des surfaces électropolies et des conceptions sans crevasses conformes aux exigences de la classe VI de l'USP. La mise à niveau a permis d'éliminer les sources de contamination, d'atteindre une efficacité de nettoyage de 99,9% et d'aider l'installation à passer les inspections de la FDA tout en réduisant les taux de rejet des produits de 85%. 😊
Comment respecter les réglementations de la FDA et des dispositifs médicaux ?
Pour respecter les réglementations de la FDA et des dispositifs médicaux, il est nécessaire d'utiliser des matériaux certifiés, de conserver une documentation détaillée et de suivre les instructions de la FDA et de la FDA. Bonnes pratiques de fabrication (BPF)3Les presse-étoupes médicaux nécessitent des matériaux approuvés par la FDA, des tests de biocompatibilité et des contrôles de fabrication qui garantissent une qualité et une sécurité constantes dans les applications de dispositifs médicaux.
La conformité réglementaire n'est pas négociable dans les applications médicales, car les défaillances peuvent entraîner des préjudices pour les patients, des rappels de produits et de graves conséquences juridiques.
Exigences de la FDA en matière de matériaux
21 CFR Part 177 : Les matériaux en contact avec des produits pharmaceutiques ou des dispositifs médicaux doivent respecter les réglementations de la FDA relatives aux additifs alimentaires pour les substances entrant indirectement en contact avec les aliments.
Fichier d'accès principal (MAF) : Les fournisseurs doivent tenir à jour les fichiers d'accès principaux de la FDA qui documentent la sécurité des matériaux, les processus de fabrication et les procédures de contrôle de la qualité.
Fichier principal des médicaments (DMF) : Pour les applications pharmaceutiques, les matériaux peuvent nécessiter l'enregistrement d'un Drug Master File avec des informations détaillées sur la composition et la fabrication.
Certificat de conformité : Les fournisseurs doivent fournir des certificats confirmant que les matériaux sont conformes à toutes les réglementations et spécifications applicables de la FDA.
Normes de qualité des dispositifs médicaux
Conformité à la norme ISO 13485 : La fabrication doit respecter les systèmes de gestion de la qualité des dispositifs médicaux ISO 13485 pour la conception, la production et la surveillance post-commercialisation.
21 CFR Part 820 (QSR) : Respect de la réglementation relative au système de qualité, garantissant des contrôles de conception appropriés, un contrôle des documents et des actions correctives/préventives.
Gestion des risques : ISO 14971 : processus de gestion des risques pour les dispositifs médicaux, y compris l'analyse des risques, l'évaluation et les mesures de contrôle.
Contrôles de la conception : Processus formels de contrôle de la conception, y compris la planification de la conception, les exigences d'entrée et de sortie, les examens, la vérification et la validation.

Documentation et traçabilité
Certificats de matériaux : Traçabilité complète des matériaux avec des certificats d'analyse, des résultats de tests de biocompatibilité et des documents de conformité réglementaire.
Registres de fabrication : Des dossiers de fabrication détaillés comprenant les paramètres du processus, les tests de contrôle de la qualité et la documentation des lots pour une traçabilité complète.
Contrôle des changements : Procédures formelles de contrôle des changements pour toute modification des matériaux, des processus ou des spécifications affectant la conformité réglementaire.
Qualification du fournisseur : Des programmes complets de qualification des fournisseurs garantissant que tous les matériaux et composants répondent aux exigences des dispositifs médicaux.
Exigences en matière de validation
Tests de biocompatibilité : Tests USP Class VI comprenant des tests d'injection systémique, intracutanée et d'implantation pour vérifier la sécurité biologique.
Validation du nettoyage : Procédures de nettoyage documentées avec des données de validation prouvant l'efficacité de l'élimination des contaminants et de la réduction de la biocontamination.
Validation de la stérilisation : Validation des processus de stérilisation, y compris la cartographie des doses, les niveaux d'assurance de stérilité et les études de compatibilité des matériaux.
Test de performance : Essais électriques, mécaniques et environnementaux pour vérifier que les performances répondent aux exigences des dispositifs médicaux tout au long du cycle de vie du produit.
Soutien aux soumissions réglementaires
Documentation 510(k) : Documentation technique à l'appui des soumissions 510(k) de la FDA pour les dispositifs médicaux incorporant des presse-étoupes.
Dossiers techniques : Fiches techniques complètes pour le marquage CE dans le cadre du règlement sur les dispositifs médicaux (MDR) sur les marchés européens.
Accords de qualité : Accords formels de qualité avec les fournisseurs définissant les responsabilités, les spécifications et les exigences de conformité.
Soutien à l'audit : Soutien aux audits de la FDA, des organismes notifiés et des clients, y compris l'examen de la documentation et les inspections des installations.
Quels sont les matériaux requis pour les applications en salle blanche ?
Les applications en salle blanche nécessitent des matériaux présentant de faibles propriétés de dégazage, une résistance à la génération de particules, une compatibilité chimique avec les agents de nettoyage, des surfaces lisses et non poreuses et des niveaux de conductivité appropriés. L'acier inoxydable 316L de qualité médicale, le PEEK, le PTFE et les polymères spécialisés approuvés pour les salles blanches offrent des performances optimales tout en répondant aux exigences de l'UE en matière d'environnement. ISO 146444 les normes des salles blanches et le maintien de l'intégrité électrique dans des environnements contrôlés.
La sélection des matériaux est essentielle car les salles blanches exigent un contrôle strict de la contamination particulaire et moléculaire qui pourrait compromettre la qualité du produit ou les conditions stériles.
Exigences en matière d'acier inoxydable
316L de qualité médicale : Acier inoxydable austénitique à faible teneur en carbone offrant une résistance supérieure à la corrosion et une biocompatibilité pour les applications médicales.
Finition électropolie : L'électropolissage permet d'éliminer les imperfections de la surface, de réduire la production de particules et de créer des surfaces lisses pour un nettoyage efficace.
Traitement de passivation : La passivation chimique améliore la résistance à la corrosion et élimine la contamination par le fer qui pourrait entraîner une décoloration ou la formation de particules.
Rugosité de la surface : Les valeurs Ra inférieures à 0,8 micromètre (32 micro-pouces) minimisent l'adhésion des bactéries et facilitent les processus de nettoyage et de stérilisation.
Polymères haute performance
PEEK (polyétheréthercétone) : L'excellente résistance chimique, le faible dégazage et la biocompatibilité font du PEEK un matériau idéal pour les applications pharmaceutiques et médicales.
PTFE (polytétrafluoroéthylène) : L'inertie chimique supérieure et les propriétés anti-adhérentes offrent une excellente résistance aux produits chimiques de nettoyage et aux matières biologiques.
Nylons de qualité médicale : Les nylons spécialement formulés avec l'approbation USP Class VI offrent de bonnes propriétés mécaniques avec une biocompatibilité pour les applications médicales.
POM approuvé pour les salles blanches : Polyoxyméthylène à faible génération de particules et bonne stabilité dimensionnelle pour les applications de précision en salle blanche.
Compatibilité avec la classification des salles blanches
ISO classe 5 (classe 100) : Surfaces ultra-lisse avec production minimale de particules pour les applications de fabrication de semi-conducteurs et de produits pharmaceutiques.
ISO Classe 6 (Classe 1000) : Contrôle modéré des particules pour la fabrication d'appareils médicaux et certains procédés pharmaceutiques.
Classe ISO 7 (classe 10000) : Exigences standard en matière de salles blanches pour les opérations générales d'assemblage de produits pharmaceutiques et de dispositifs médicaux.
Classe ISO 8 (classe 100000) : Exigences de base en matière de salles blanches pour l'emballage et certains processus de fabrication de dispositifs médicaux.
Contrôle des dégagements gazeux et de la contamination
Matériaux à faible dégagement gazeux : Matériaux dont les émissions de composés organiques volatils (COV), susceptibles de contaminer des processus ou des produits sensibles, sont minimes.
Contamination moléculaire : Contrôle des contaminants moléculaires, y compris les silicones, les plastifiants et d'autres composés organiques susceptibles d'affecter la qualité du produit.
Contamination ionique : Matériaux à faible teneur ionique pour éviter la contamination des composants électroniques et des produits pharmaceutiques.
Substances extractibles : Un minimum de substances extractibles qui pourraient se déverser dans les produits pharmaceutiques ou les solutions de nettoyage pendant l'utilisation.
Matrice de compatibilité chimique
| Agent de nettoyage | ACIER INOXYDABLE 316L | PEEK | PTFE | Nylon médical |
|---|---|---|---|---|
| Alcool isopropylique | Excellent | Excellent | Excellent | Bon |
| Peroxyde d'hydrogène | Excellent | Excellent | Excellent | Juste |
| Ammonium quaternaire | Excellent | Excellent | Excellent | Bon |
| Hypochlorite de sodium | Bon | Excellent | Excellent | Pauvre |
| Acide peracétique | Bon | Excellent | Excellent | Pauvre |
Hassan, qui dirige les opérations d'une installation pharmaceutique de pointe en Suisse, avait besoin de moderniser les presse-étoupes de sa salle blanche de classe ISO 5 pour la fabrication de produits injectables stériles. Les presse-étoupes existants généraient des particules pendant les cycles de nettoyage et ne pouvaient pas résister aux protocoles de stérilisation agressifs requis pour leurs nouveaux produits biologiques. Nous avons fourni des presse-étoupes en acier inoxydable 316L électropoli avec une faible génération de particules validée et une compatibilité chimique totale avec leurs processus de nettoyage et de stérilisation. La mise à niveau a permis d'atteindre un nombre de particules 90% inférieur aux limites de la classe ISO 5, d'éliminer les événements de contamination liés au nettoyage et de soutenir la validation réussie de leur nouvelle ligne de fabrication stérile.
Comment s'assurer de la compatibilité avec le nettoyage et la stérilisation ?
Pour garantir la compatibilité avec le nettoyage et la stérilisation, il faut sélectionner des matériaux qui résistent à une exposition répétée aux produits chimiques de nettoyage et aux méthodes de stérilisation, concevoir des surfaces parfaitement nettoyables, valider les procédures de nettoyage et conserver une documentation détaillée. Les presse-étoupes médicaux nécessitent des surfaces lisses et exemptes de crevasses, des matériaux résistants aux produits chimiques et des protocoles de nettoyage validés qui permettent d'atteindre les niveaux d'assurance de stérilité exigés.
La compatibilité du nettoyage et de la stérilisation est essentielle, car une décontamination inadéquate peut entraîner une contamination des produits, des risques pour la sécurité des patients et des violations de la réglementation.
Compatibilité avec les méthodes de stérilisation
Autoclavage à la vapeur : Les matériaux doivent résister à 121°C-134°C autoclavage à la vapeur5 sans dégradation, changement de dimension ou défaillance du joint.
Rayonnement gamma : Résistance aux doses de rayonnement gamma de 25 à 50 kGy couramment utilisées pour la stérilisation des dispositifs médicaux sans dégradation du matériau.
Oxyde d'éthylène (EtO) : Compatibilité chimique avec la stérilisation à l'EtO, y compris la résistance à l'agent stérilisant et les caractéristiques de dégazage appropriées.
Plasma de peroxyde d'hydrogène : Compatibilité avec les systèmes de stérilisation au plasma à basse température, y compris la stabilité des matériaux et la pénétration complète de l'agent stérilisant.
Exigences en matière de validation du nettoyage
Procédures de nettoyage : Procédures de nettoyage documentées spécifiant les produits chimiques, les concentrations, les temps de contact et l'action mécanique nécessaires à une décontamination efficace.
Protocoles de validation : Études de validation formelle démontrant l'efficacité du nettoyage à l'aide de scénarios de contamination les plus défavorables et de tests analytiques.
Critères d'acceptation : Critères d'acceptation définis pour la propreté, y compris l'inspection visuelle, la numération des particules, les niveaux de biocontamination et les limites de résidus chimiques.
Surveillance de routine : Programmes de surveillance continue pour vérifier l'efficacité du nettoyage et identifier toute dégradation des performances.
Considérations relatives à la conception de la surface
Caractéristiques de drainage : Concevoir des caractéristiques qui favorisent l'évacuation complète des solutions de nettoyage et empêchent la formation de flaques susceptibles d'abriter des contaminants.
Accessibilité : Toutes les surfaces doivent pouvoir être nettoyées à l'aide des outils et procédures de nettoyage standard utilisés dans les établissements médicaux.
Exigences de démontage : Il convient de déterminer si les presse-étoupes doivent être démontés pour être nettoyés ou si un nettoyage intact est suffisant pour l'application.
Remplacement du joint : Procédures de remplacement et de validation des joints lorsque les composants d'étanchéité doivent être remplacés périodiquement en raison de l'exposition aux produits chimiques de nettoyage.
Documentation et conformité
Instructions de nettoyage : Instructions de nettoyage détaillées comprenant des procédures étape par étape, des spécifications chimiques et des précautions de sécurité.
Données de sécurité : Informations complètes sur la sécurité des matériaux, y compris la compatibilité chimique, les limites de température et la compatibilité avec la stérilisation.
Rapports de validation : Rapports de validation du nettoyage démontrant l'efficacité et établissant les exigences en matière de contrôle de routine.
Matériel de formation : Matériel de formation pour le personnel de l'établissement sur les procédures de nettoyage, de manipulation et d'entretien des presse-étoupes médicaux.
Essais de contrôle de la qualité
Test de charge biologique : Des tests réguliers de contamination microbienne pour vérifier l'efficacité du nettoyage et identifier les zones à problèmes potentiels.
Test d'endotoxine : Recherche d'endotoxines bactériennes susceptibles de provoquer des réactions pyrogènes dans les applications pharmaceutiques et les dispositifs médicaux.
Comptage des particules : Test de comptage des particules pour vérifier que les exigences de la salle blanche sont respectées après les activités de nettoyage et d'entretien.
Analyse des résidus chimiques : Recherche de résidus de produits chimiques de nettoyage susceptibles de contaminer les produits ou d'affecter la biocompatibilité.
Quels sont les principaux critères de sélection pour les différentes applications médicales ?
Les principaux critères de sélection varient en fonction de l'application, mais comprennent les exigences de conformité réglementaire, les niveaux de biocompatibilité, les classifications des salles blanches, les méthodes de stérilisation, l'exposition aux produits chimiques et les besoins en matière de performances électriques. Les équipements chirurgicaux nécessitent une biocompatibilité maximale, la fabrication de produits pharmaceutiques requiert une résistance chimique et les équipements de diagnostic se concentrent sur l'intégrité électrique, tandis que toutes les applications requièrent des certifications réglementaires appropriées et une compatibilité avec le nettoyage.
Les différentes applications médicales ont des exigences uniques qui doivent être soigneusement prises en compte lors de la sélection du presse-étoupe afin de garantir des performances optimales et la conformité aux réglementations.
Équipement chirurgical et de contact avec le patient
Exigences en matière de contact direct : Biocompatibilité USP classe VI avec tests de cytotoxicité supplémentaires pour les matériaux en contact direct avec le patient pendant les procédures chirurgicales.
Fréquence de stérilisation : Capacité à supporter des cycles de stérilisation fréquents sans dégradation, ce qui nécessite généralement des matériaux stables pendant des centaines de cycles de stérilisation.
Sécurité électrique : Exigences accrues en matière de sécurité électrique, notamment un faible courant de fuite et une isolation fiable pour les équipements connectés aux patients.
Fiabilité en cas d'urgence : Exigences critiques de fiabilité pour les équipements de maintien en vie et les équipements médicaux d'urgence dont la défaillance peut avoir un impact direct sur la sécurité des patients.
Fabrication de produits pharmaceutiques
Conformité aux BPF : les exigences en matière de bonnes pratiques de fabrication, y compris la traçabilité des matériaux, le contrôle des modifications et la documentation de validation.
Sécurité du contact avec le produit : Matériaux qui ne contaminent pas les produits pharmaceutiques par lixiviation, génération de particules ou interaction chimique.
Validation du nettoyage : Exigences étendues en matière de validation du nettoyage, avec des procédures documentées et des critères d'acceptation pour la fabrication de produits pharmaceutiques.
Documentation des lots : Documentation complète des lots et traçabilité des matériaux utilisés dans les équipements de fabrication pharmaceutique.
Équipement de diagnostic et de laboratoire
Exigences de précision : Stabilité dimensionnelle et précision pour les instruments d'analyse exigeant des performances mécaniques et électriques constantes.
Résistance chimique : Résistance aux produits chimiques de laboratoire, aux réactifs et aux solvants de nettoyage couramment utilisés dans les applications de diagnostic.
Performance EMC : Exigences en matière de compatibilité électromagnétique pour les instruments d'analyse et les équipements de diagnostic sensibles.
Stabilité de l'étalonnage : Stabilité mécanique qui n'affecte pas l'étalonnage de l'instrument ou la précision des mesures au fil du temps.
Fabrication de dispositifs médicaux
Validation des processus : Matériaux et composants qui répondent aux exigences de validation des processus pour la fabrication de dispositifs médicaux.
Systèmes de qualité : Intégration dans les systèmes de qualité ISO 13485, y compris la qualification des fournisseurs et les procédures d'inspection à la réception.
Gestion des risques : Matériaux qui soutiennent les exigences en matière de gestion des risques des dispositifs médicaux, y compris l'analyse des modes de défaillance et les stratégies d'atténuation.
Soutien réglementaire : Soutien des fournisseurs pour les soumissions réglementaires, y compris la documentation technique et l'expertise réglementaire.
Matrice de décision de la sélection
| Type d'application | Critères primaires | Critères secondaires | Normes critiques |
|---|---|---|---|
| Matériel chirurgical | Biocompatibilité | Stérilisation | USP Classe VI, ISO 10993 |
| Pharmaceutique | Résistance chimique | Conformité aux BPF | FDA 21 CFR, cGMP |
| Diagnostic | Précision | Performances EMC | IEC 61326, ISO 15189 |
| Fabrication | Validation des processus | Systèmes de qualité | ISO 13485, 21 CFR 820 |
Analyse coûts-bénéfices
Coût initial et cycle de vie : Prendre en compte le coût total de possession, y compris les coûts d'entretien, de remplacement et de mise en conformité sur la durée de vie de l'équipement.
Risque réglementaire : Mettre en balance les coûts matériels avec les risques de non-conformité réglementaire et les coûts potentiels de la non-conformité.
Exigences de performance : Veiller à ce que les matériaux sélectionnés répondent aux exigences minimales en matière de performances, sans surspécification qui augmenterait inutilement les coûts.
Capacités des fournisseurs : Évaluer les capacités des fournisseurs en matière de soutien continu, de documentation et d'assistance à la conformité réglementaire.
Conclusion
La sélection de presse-étoupes pour les équipements médicaux et les salles blanches nécessite de comprendre les exigences uniques en matière de réglementation, de matériaux et de performances qui distinguent ces applications des utilisations industrielles standard. Le succès dépend de l'équilibre entre la biocompatibilité, la nettoyabilité, la conformité réglementaire et les performances électriques.
La clé d'une performance fiable des presse-étoupes médicaux réside dans la collaboration avec des fournisseurs qui comprennent les réglementations relatives aux dispositifs médicaux et qui peuvent fournir les matériaux appropriés, la documentation et l'assistance continue tout au long du cycle de vie du produit. Chez Bepto, nous sommes spécialisés dans les presse-étoupes de qualité médicale qui répondent aux exigences de la FDA et aux normes internationales relatives aux dispositifs médicaux, offrant ainsi l'assurance qualité et le soutien réglementaire nécessaires aux applications de soins de santé critiques.
FAQ sur les presse-étoupes médicaux
Q : Quelles sont les certifications requises pour les presse-étoupes médicaux ?
A : Les presse-étoupes médicaux nécessitent généralement une certification de biocompatibilité USP Classe VI, une conformité FDA 21 CFR pour les matériaux et des systèmes de qualité de fabrication ISO 13485. Les exigences spécifiques dépendent de votre application et de la juridiction réglementaire.
Q : Les presse-étoupes ordinaires en acier inoxydable peuvent-ils être utilisés dans des applications médicales ?
A : L'acier inoxydable ordinaire peut ne pas répondre aux exigences médicales. Les applications médicales nécessitent de l'acier inoxydable 316L de qualité médicale avec une finition électropolie, des tests de biocompatibilité et une documentation appropriée pour la conformité réglementaire.
Q : Comment nettoyer et stériliser les presse-étoupes médicaux ?
A : Suivre les procédures de nettoyage validées par le fabricant en utilisant des agents de nettoyage et des méthodes de stérilisation approuvés. La plupart des glandes médicales peuvent être stérilisées à la vapeur, aux rayons gamma ou aux produits chimiques, à condition que les matériaux soient compatibles.
Q : Quelle est la différence entre les presse-étoupes pour salle blanche et les presse-étoupes de qualité médicale ?
A : La qualité médicale comprend les exigences de biocompatibilité et la conformité à la FDA, tandis que la qualité pour salle blanche se concentre sur le contrôle des particules et la résistance aux produits chimiques. Certaines applications requièrent à la fois des spécifications médicales et des spécifications pour salles blanches.
Q : À quelle fréquence les presse-étoupes médicaux doivent-ils être remplacés ?
A : La fréquence de remplacement dépend des cycles de stérilisation, de l'exposition aux produits chimiques et des recommandations du fabricant. En règle générale, l'inspection a lieu tous les 100 à 200 cycles de stérilisation et le remplacement se fait en fonction de l'évaluation de l'état et des exigences de validation.
-
Découvrez les tests de réactivité biologique spécifiques requis pour la certification USP Class VI. ↩
-
Accédez à une vue d'ensemble de la série de normes ISO 10993 pour l'évaluation biologique des dispositifs médicaux. ↩
-
Examiner les directives et règlements officiels de la FDA concernant les bonnes pratiques de fabrication (cGMP). ↩
-
Découvrez un guide détaillé des normes ISO 14644 pour la classification de la propreté de l'air dans les salles blanches. ↩
-
Comprendre les principes de la stérilisation à la vapeur, y compris le rôle de la durée, de la température et de la pression. ↩



