Los fallos en la esterilización de dispositivos médicos cuestan millones a los fabricantes cada año, y entre el 15 y el 20% de los fallos se atribuyen a una ventilación inadecuada que impide la penetración adecuada del esterilizante. Los tapones de ventilación estándar fallan bajo autoclave1 temperaturas de 121-134°C o se degradan cuando se exponen a esterilización por óxido de etileno (ETO)2 químicos, comprometiendo la garantía de esterilidad y el cumplimiento de la normativa.
Los tapones de ventilación esterilizables permiten una esterilización eficaz al permitir la penetración de vapor o gas ETO, al tiempo que mantienen las barreras estériles tras la esterilización. Los orificios de ventilación con membrana de PTFE soportan temperaturas de autoclave de hasta 150 °C y resisten la degradación química por ETO, lo que garantiza un mantenimiento fiable de la esterilidad para dispositivos médicos, equipos farmacéuticos e instrumentos de laboratorio que requieren procesos de esterilización validados.
El año pasado, trabajé con la Dra. Sarah Mitchell, directora de calidad de un importante fabricante de dispositivos médicos de Boston, que experimentaba fallos en la validación de la esterilización de los envases de sus dispositivos implantables. Sus tapones de ventilación de nailon estándar se derretían durante los ciclos de autoclave e impedían la correcta penetración del vapor. Tras cambiar a nuestros tapones de ventilación esterilizables de PTFE de calidad farmacéutica con resistencia a la temperatura validada, consiguieron una eficacia de esterilización 100% en 1.000 ciclos de validación, lo que garantiza el cumplimiento de la FDA y la seguridad de los pacientes. 🏥
Índice
- ¿Qué son los tapones de ventilación esterilizables y por qué son fundamentales?
- ¿Cómo afectan los distintos métodos de esterilización a los materiales de los tapones de ventilación?
- ¿Qué materiales son los mejores para la esterilización en autoclave?
- ¿Qué materiales funcionan mejor en los procesos de esterilización por ETO?
- ¿Cómo se seleccionan y validan los tapones de ventilación esterilizables?
- Preguntas frecuentes sobre los tapones de ventilación esterilizables
¿Qué son los tapones de ventilación esterilizables y por qué son fundamentales?
Comprender el papel de los tapones de ventilación esterilizables en la fabricación de productos sanitarios y farmacéuticos es esencial para mantener la garantía de esterilidad y el cumplimiento de la normativa.
Los tapones de ventilación esterilizables son respiraderos especializados diseñados para resistir los procesos de esterilización, permitiendo la penetración del esterilizante y manteniendo las barreras estériles. Permiten el desplazamiento del aire durante la esterilización, evitan la formación de vacío durante el enfriamiento y mantienen las condiciones estériles tras la esterilización. Las aplicaciones críticas incluyen el envasado de dispositivos médicos, contenedores farmacéuticos, equipos de laboratorio y equipos de procesamiento estéril.
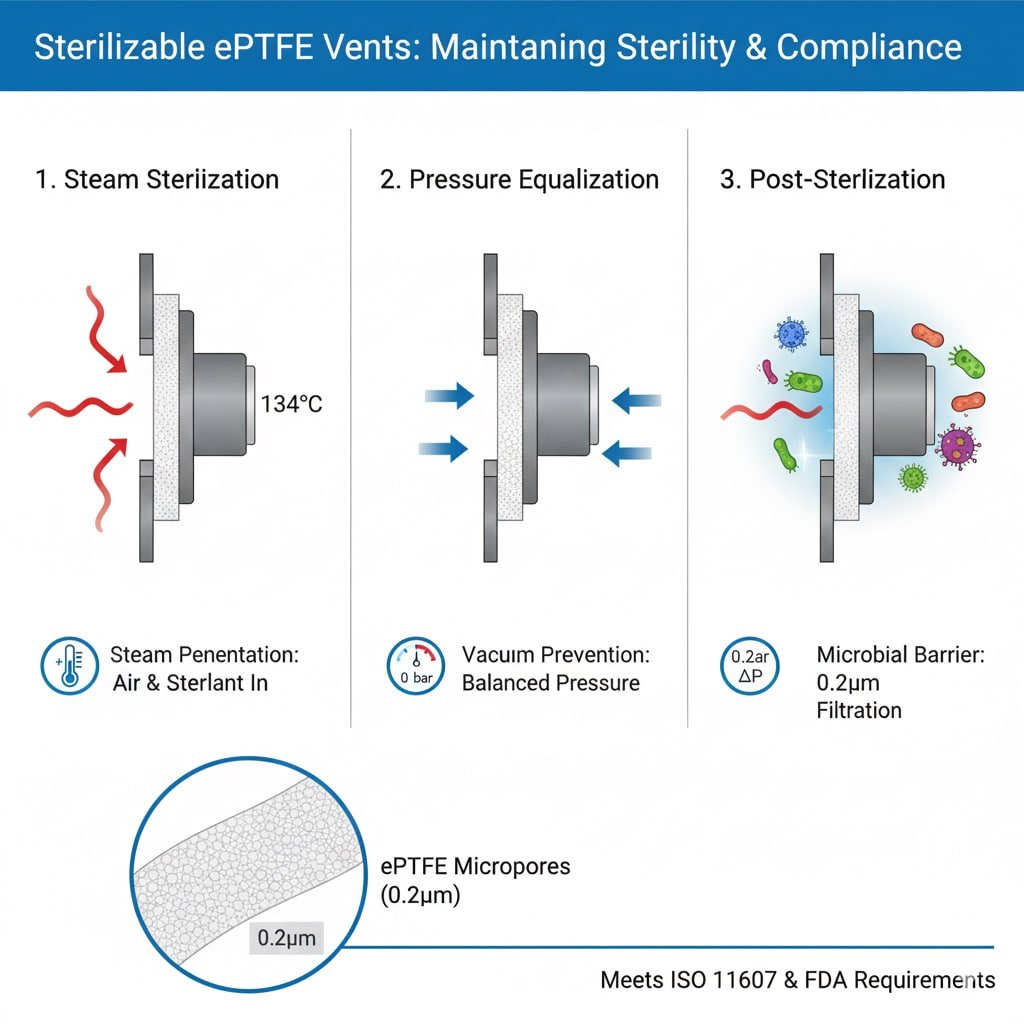
Requisitos del proceso de esterilización
Penetración de vapor: La esterilización en autoclave requiere que el vapor penetre en el envase y entre en contacto con todas las superficies, por lo que se necesitan respiraderos que permitan el flujo de gas al tiempo que mantienen las barreras microbianas.
Desplazamiento del aire: La esterilización eficaz requiere la eliminación completa del aire y su sustitución por esterilizante, lo que los respiraderos facilitan mediante el intercambio controlado de gases.
Ecualización de la presión: Los ciclos de esterilización crean diferenciales de presión que los respiraderos deben acomodar sin comprometer las barreras estériles o la integridad del envase.
Parámetros críticos de rendimiento
Resistencia a la temperatura: Los respiraderos esterilizables deben mantener la integridad estructural y el rendimiento de filtración a temperaturas de esterilización que oscilen entre 121 °C y 150 °C.
Compatibilidad química: Los materiales deben resistir la degradación provocada por los productos químicos de esterilización, como el vapor, el óxido de etileno, el peróxido de hidrógeno y el ozono.
Eficacia de la barrera microbiana: Tras la esterilización, los respiraderos deben proporcionar una barrera microbiana3 con tamaños de poro típicamente de 0,2-0,22 micras para la retención bacteriana.
Consideraciones sobre el cumplimiento de la normativa
Requisitos de validación de la FDA: Las aplicaciones de dispositivos médicos requieren procesos de esterilización validados con un rendimiento de ventilación documentado a lo largo de los ciclos de esterilización.
Cumplimiento de las normas ISO: Los respiraderos esterilizables deben cumplir ISO 116074 normas de envasado y requisitos de esterilización por vapor ISO 17665 para aplicaciones médicas.
Pruebas de biocompatibilidad: Las aplicaciones de contacto con dispositivos médicos pueden requerir pruebas de biocompatibilidad USP Clase VI para garantizar la seguridad del paciente.
Categorías de aplicaciones
Envasado de productos sanitarios: Embalaje estéril para implantes, instrumentos quirúrgicos y dispositivos médicos desechables que requieren mantenimiento de la esterilidad hasta su uso.
Fabricación farmacéutica: Equipos de procesamiento estériles, biorreactores y contenedores farmacéuticos que requieren procesos de esterilización validados.
Equipo de laboratorio: Recipientes de laboratorio esterilizables en autoclave, recipientes de cultivo y equipos analíticos que requieren condiciones estériles para obtener resultados precisos.
¿Cómo afectan los distintos métodos de esterilización a los materiales de los tapones de ventilación?
Los diferentes métodos de esterilización plantean retos únicos para los materiales de los tapones de ventilación, que requieren propiedades específicas de los materiales y consideraciones de diseño para un rendimiento óptimo.
La esterilización por vapor somete los materiales a altas temperaturas (121-134°C) y a condiciones de vapor saturado que pueden causar degradación térmica, cambios dimensionales y daños en las membranas. La esterilización por ETO expone los materiales a productos químicos reactivos a temperaturas más bajas (37-63°C) pero con tiempos de exposición más largos que pueden causar degradación química y desgasificación. Cada método requiere una selección específica del material para obtener un rendimiento fiable.
Efectos de la esterilización por vapor
Estrés térmico: Las altas temperaturas provocan dilatación térmica, posible fusión de los componentes termoplásticos y degradación de los materiales sensibles a la temperatura.
Reacciones de hidrólisis5: La exposición al vapor puede provocar la degradación hidrolítica de ciertos polímeros, en particular los poliésteres y algunas poliamidas.
Estabilidad dimensional: Los ciclos térmicos repetidos pueden provocar cambios dimensionales que afectan al rendimiento de la estanquidad y a la eficacia de la filtración.
Desafíos de la esterilización ETO
Reactividad química: El óxido de etileno reacciona con materiales que contienen átomos de hidrógeno activos, lo que puede alterar las propiedades de los materiales y crear residuos tóxicos.
Requisitos de desgasificación: Los productos esterilizados con ETO requieren periodos de aireación prolongados para eliminar la ETO absorbida y los productos de reacción antes de su uso seguro.
Características de penetración: La ETO requiere condiciones específicas de humedad y temperatura para una penetración eficaz, lo que afecta a los requisitos de diseño de los respiraderos.
Efectos del plasma de peróxido de hidrógeno
Degradación oxidativa: El plasma de H2O2 crea especies altamente reactivas que pueden degradar materiales orgánicos mediante reacciones de oxidación.
Compatibilidad de materiales: Muchos elastómeros y algunos plásticos son incompatibles con la esterilización por plasma H2O2 debido a su rápida degradación.
Ventajas a baja temperatura: La esterilización por plasma funciona a bajas temperaturas (45-55°C), lo que reduce el estrés térmico sobre los materiales sensibles a la temperatura.
Consideraciones sobre la radiación gamma
Daños por radiación: La radiación gamma de alta energía puede provocar la escisión o reticulación de la cadena polimérica, alterando significativamente las propiedades del material.
Acumulación de dosis: La esterilización gamma repetida puede causar daños acumulativos, limitando el número de ciclos de esterilización que pueden soportar los materiales.
Necesidades de antioxidantes: Las formulaciones resistentes a la radiación suelen requerir antioxidantes para evitar la degradación oxidativa durante y después de la irradiación.
Hace poco ayudé a Ahmed Al-Rashid, director de operaciones de una planta farmacéutica de Dubai, a resolver los problemas de validación de la esterilización por ETO de sus sistemas de ventilación de biorreactores. Sus tapones de ventilación estándar absorbían la ETO y requerían largos periodos de aireación de 14 días que interrumpían los programas de producción. Mediante la implementación de nuestros tapones de ventilación de PTFE compatibles con ETO con características de absorción mínimas, redujeron el tiempo de aireación a 24 horas mientras mantenían la garantía de esterilidad completa, ¡mejorando drásticamente la eficiencia de la producción! 🚀
¿Qué materiales son los mejores para la esterilización en autoclave?
La selección de los materiales adecuados para la esterilización en autoclave requiere conocer la estabilidad térmica, la resistencia a la hidrólisis y el rendimiento a largo plazo bajo una exposición repetida al vapor.
El PTFE (politetrafluoroetileno) ofrece un rendimiento superior en autoclave con temperaturas de servicio continuo de hasta 260°C, una excelente inercia química y resistencia a la hidrólisis. El PVDF (fluoruro de polivinilideno) ofrece una buena estabilidad térmica hasta 150°C con un coste inferior. Evite el nailon, el polietileno estándar y la mayoría de los elastómeros que se degradan en condiciones de autoclave, comprometiendo el rendimiento de filtración y sellado.
Ventajas de la membrana de PTFE
Excepcional resistencia a la temperatura: El PTFE mantiene la integridad estructural y el rendimiento de filtración a temperaturas muy superiores a las condiciones típicas de autoclave (121-134°C).
Inercia química: El PTFE resiste la degradación por el vapor, los productos químicos de limpieza y los subproductos de la esterilización, lo que garantiza un rendimiento constante a largo plazo.
Propiedades hidrófobas: La naturaleza hidrófoba del PTFE evita la absorción de agua y mantiene la estabilidad dimensional a lo largo de los ciclos de esterilización.
Comparación del rendimiento de los materiales
| Material | Temperatura máxima (°C) | Resistencia al vapor | Resistencia a la hidrólisis | Factor de coste |
|---|---|---|---|---|
| PTFE | 260 | Excelente | Excelente | Alta |
| PVDF | 150 | Bien | Bien | Medio |
| PP (polipropileno) | 135 | Feria | Feria | Bajo |
| Nylon | 80-100 | Pobre | Pobre | Bajo |
Selección del material de la carcasa
Acero inoxidable 316L: Proporciona una excelente resistencia a la corrosión, estabilidad térmica y facilidad de limpieza para aplicaciones farmacéuticas y médicas que requieren procedimientos de limpieza validados.
PEEK (Polieteretercetona): Ofrece una extraordinaria estabilidad térmica (uso continuo hasta 250°C) con una excelente resistencia química para aplicaciones exigentes en autoclave.
Polipropileno: Opción rentable para aplicaciones de un solo uso con un rendimiento adecuado para ciclos estándar de autoclave a 121°C.
Consideraciones sobre los componentes de estanquidad
Juntas tóricas de EPDM: Proporcionan una buena resistencia al vapor y estabilidad térmica para temperaturas de hasta 150°C con un excelente rendimiento de sellado.
Juntas de silicona: Ofrecen una resistencia superior a la temperatura (hasta 200°C), pero pueden presentar problemas de compatibilidad con determinados productos químicos de limpieza.
Juntas tóricas encapsuladas de PTFE: Combinan la resistencia química del PTFE con las propiedades de estanquidad de los elastómeros para aplicaciones exigentes que requieren ambas características de rendimiento.
Optimización del diseño para el uso de autoclaves
Alojamiento de expansión térmica: Los diseños de los respiraderos deben tener en cuenta la dilatación térmica diferencial entre los materiales para evitar fallos de estanquidad durante los ciclos de temperatura.
Características del drenaje: Un diseño de drenaje adecuado evita la acumulación de condensado que podría comprometer el rendimiento de la filtración o crear riesgos de contaminación.
Apoyo a la validación: Las características del diseño deben facilitar las pruebas de validación, incluida la descomposición por presión, el desafío microbiano y la verificación del rendimiento térmico.
¿Qué materiales funcionan mejor en los procesos de esterilización por ETO?
La esterilización por ETO presenta retos materiales únicos que requieren compatibilidad química, absorción mínima y características de desgasificación rápida para un procesamiento eficaz.
El PTFE y el PVDF ofrecen una excelente compatibilidad con la ETO, con una absorción química mínima y una rápida desgasificación. Evite los materiales con sitios de hidrógeno activo, como el nailon, el PVC y el caucho natural, que reaccionan con la ETO formando compuestos tóxicos. Las carcasas de acero inoxidable ofrecen una resistencia química óptima, mientras que las juntas de silicona ofrecen una buena compatibilidad ETO con características de desgasificación aceptables para la mayoría de las aplicaciones.
Compatibilidad química ETO
Mecanismos de reacción: El ETO reacciona con materiales que contienen grupos hidroxilo, amino, carboxilo y sulfhidrilo, formando derivados del etilenglicol y otros compuestos potencialmente tóxicos.
Características de absorción: Los materiales con alta absorción de ETO requieren periodos de aireación prolongados, lo que aumenta considerablemente el tiempo de procesamiento y los costes.
Cinética de desgasificación: Los materiales de desgasificación rápida permiten ciclos de aireación más cortos, mejorando la eficacia del proceso y reduciendo los tiempos de mantenimiento de existencias.
Clasificación de los resultados de la ETO
Excelente compatibilidad ETO:
- PTFE: Mínima absorción, rápida desgasificación, sin reactividad química
- PVDF: Baja absorción, buena desgasificación, excelente resistencia química
- Acero inoxidable: Sin absorción, capacidad de uso inmediato
Buena compatibilidad ETO:
- Polipropileno: Absorción moderada, desgasificación aceptable
- Silicona: Baja reactividad, requisitos de desgasificación moderados
Mala compatibilidad ETO:
- Nylon: Alta reactividad, requiere aireación prolongada
- PVC: degradación química, formación de compuestos tóxicos
- Caucho natural: Alta absorción, degradación potencial
Requisitos de tiempo de aireación
| Material | Tiempo de aireación típico | Nivel de absorción de ETO | Tasa de desgasificación |
|---|---|---|---|
| PTFE | 8-24 horas | Mínimo | Rápido |
| PVDF | 24-48 horas | Bajo | Bien |
| Polipropileno | 48-72 horas | Moderado | Moderado |
| Nylon | 7-14 días | Alta | Lento |
Optimización de los parámetros del proceso
Control de temperatura: La esterilización por ETO suele funcionar a 37-63°C, por lo que se requieren materiales que mantengan su rendimiento en este intervalo de temperaturas.
Requisitos de humedad: La eficacia de la ETO requiere una humedad relativa de 40-80%, por lo que se necesitan materiales que ofrezcan un rendimiento constante en estas condiciones de humedad.
Gestión de la concentración de gases: Las concentraciones de ETO de 450-1200 mg/L requieren materiales que resistan el ataque químico a la vez que permiten la penetración del esterilizante.
Consideraciones sobre la validación
Pruebas de residuos: Los productos esterilizados con ETO requieren pruebas de residuos de ETO y productos de reacción para garantizar el cumplimiento de los límites de seguridad.
Mantenimiento de la biocompatibilidad: Los materiales deben mantener su biocompatibilidad tras la exposición a la ETO y la aireación, lo que requiere una selección de materiales validada.
Supervisión de procesos: La esterilización por ETO requiere un control continuo de la temperatura, la humedad, la presión y la concentración de gas durante todo el ciclo.
¿Cómo se seleccionan y validan los tapones de ventilación esterilizables?
La selección y validación adecuadas de los tapones de ventilación esterilizables garantizan un rendimiento fiable de la esterilización, el cumplimiento de la normativa y el éxito operativo a largo plazo.
La selección requiere adecuar las propiedades del material al método de esterilización, definir los requisitos de rendimiento y tener en cuenta las normas reglamentarias. La validación implica pruebas de rendimiento térmico, estudios de desafío microbiano, evaluación de la compatibilidad química y evaluación de la estabilidad a largo plazo. Documente todas las pruebas de acuerdo con las normas FDA e ISO para la presentación reglamentaria y el cumplimiento del sistema de calidad.
Marco de criterios de selección
Compatibilidad con el método de esterilización: Adapte los materiales de ventilación a métodos de esterilización específicos (vapor, ETO, plasma H2O2, rayos gamma) en función de los requisitos de temperatura, resistencia química y a la radiación.
Especificaciones de rendimiento: Definir los caudales requeridos, las presiones nominales, la eficacia de filtración y las propiedades de barrera microbiana en función de los requisitos de la aplicación.
Requisitos reglamentarios: Tenga en cuenta la clasificación de dispositivos de la FDA, el cumplimiento de las normas ISO y los requisitos de biocompatibilidad para las aplicaciones de uso previsto.
Parámetros de evaluación de la aplicación
Entorno operativo: Evalúe los rangos de temperatura, la exposición química, las condiciones de presión y los riesgos de contaminación a lo largo del ciclo de vida del producto.
Frecuencia de esterilización: Considere el uso único frente a los múltiples ciclos de esterilización y los efectos acumulativos sobre el rendimiento y la fiabilidad del material.
Ámbito de validación: Determinar los requisitos de ensayo basándose en la evaluación de riesgos, la vía reglamentaria y los requisitos del sistema de calidad.
Protocolo de pruebas de validación
Pruebas de rendimiento térmico:
- Ciclos de temperatura en condiciones de esterilización
- Medición de la estabilidad dimensional
- Verificación de la eficacia de filtración tras la exposición térmica
Pruebas de desafío microbiano:
- Desafío bacteriano con organismos de prueba apropiados
- Verificación del mantenimiento de la esterilidad
- Evaluación de la integridad de la barrera a largo plazo
Evaluación de la compatibilidad química:
- Evaluación de la degradación del material
- Pruebas de extraíbles y lixiviables
- Verificación del mantenimiento de la biocompatibilidad
Requisitos de documentación
Especificaciones del material: Hojas de datos de materiales completas que incluyen la composición química, las propiedades térmicas y las certificaciones reglamentarias.
Protocolos de prueba: Protocolos de validación detallados que siguen las directrices de la FDA y las normas ISO para la validación de la esterilización.
Datos de rendimiento: Resultados exhaustivos de las pruebas que demuestran el rendimiento en todas las condiciones de funcionamiento y ciclos de esterilización especificados.
Integración del sistema de calidad
Calificación de proveedores: Establecer acuerdos de calidad con los proveedores, incluidos los requisitos de trazabilidad de materiales, control de cambios y documentación de calidad.
Inspección entrante: Desarrollar procedimientos de inspección para verificar las dimensiones críticas, las propiedades de los materiales y las características de rendimiento.
Validación del proceso: Integrar el rendimiento de la ventilación en la validación general del proceso de esterilización, incluidas las pruebas en el peor de los casos.
Consideraciones sobre la gestión de riesgos
Análisis modal de fallos: Identificar los posibles modos de fallo, incluida la degradación del material, el fallo del sellado y el compromiso de la filtración, con las estrategias de mitigación adecuadas.
Control de cambios: Establecer procedimientos para gestionar los cambios de material, los cambios de proveedores y las modificaciones de especificaciones con los requisitos de revalidación adecuados.
Control continuo: Implemente programas de supervisión continua para verificar el rendimiento continuado e identificar posibles problemas antes de que afecten a la calidad del producto.
Conclusión
Los tapones de ventilación esterilizables desempeñan un papel fundamental a la hora de garantizar una esterilización eficaz a la vez que se mantienen las barreras estériles en aplicaciones de dispositivos médicos y farmacéuticos. Comprender los retos específicos de los distintos métodos de esterilización y seleccionar los materiales adecuados es esencial para un rendimiento fiable y el cumplimiento de la normativa.
Los tapones de ventilación a base de PTFE ofrecen un rendimiento superior en múltiples métodos de esterilización, proporcionando una excelente resistencia a la temperatura, compatibilidad química y fiabilidad a largo plazo. Una selección y validación adecuadas garantizan una eficacia de esterilización óptima al tiempo que minimizan el tiempo y los costes de procesamiento.
En Bepto, nuestra amplia gama de tapones de ventilación esterilizables incluye membranas de PTFE de calidad farmacéutica, rendimiento de temperatura validado y paquetes completos de documentación para presentaciones reglamentarias. Con más de una década de experiencia en aplicaciones de ventilación especializadas y capacidades de fabricación con certificación ISO, ofrecemos las soluciones fiables y rentables que necesita para aplicaciones de esterilización críticas. Confíe en nosotros para mantener sus procesos de esterilización validados y sus productos seguros. 🔬
Preguntas frecuentes sobre los tapones de ventilación esterilizables
P: ¿Se puede utilizar el mismo tapón de ventilación para la esterilización en autoclave y ETO?
A: Sí, los tapones de ventilación de membrana de PTFE pueden soportar eficazmente tanto la esterilización en autoclave como la esterilización por ETO. El PTFE ofrece una excelente resistencia a la temperatura para los ciclos de autoclave y una mínima absorción de ETO para una rápida aireación, por lo que es ideal para instalaciones que utilizan varios métodos de esterilización.
P: ¿Cuántos ciclos de esterilización puede soportar un tapón de ventilación?
A: Los tapones de ventilación de PTFE de alta calidad suelen resistir más de 100 ciclos de autoclave o más de 50 ciclos de ETO manteniendo el rendimiento de la filtración. La vida útil real depende de los parámetros de esterilización, los procedimientos de manipulación y los criterios de aceptación del rendimiento para su aplicación específica.
P: ¿Qué tamaño de poro se requiere para la filtración estéril en aplicaciones médicas?
A: Las aplicaciones médicas suelen requerir tamaños de poro de 0,2 ó 0,22 micras para una retención bacteriana fiable. Este tamaño de poro proporciona una garantía de esterilidad validada al tiempo que permite un flujo de gas adecuado para una esterilización y una igualación de presión eficaces.
P: ¿Los tapones de ventilación esterilizables requieren pruebas de validación especiales?
A: Sí, los tapones de ventilación esterilizables requieren pruebas de validación que incluyan estudios de rendimiento térmico, desafío microbiano y compatibilidad de materiales. Las pruebas deben seguir las directrices de la FDA y las normas ISO, con documentación que respalde la validación del proceso de esterilización y las presentaciones reglamentarias.
P: ¿Cómo se evita la contaminación del tapón de ventilación durante la esterilización?
A: Evite la contaminación mediante una instalación adecuada, cubiertas protectoras durante la manipulación, parámetros de esterilización validados y un almacenamiento postesterilización apropiado. Utilice una técnica estéril durante la instalación y asegúrese de que los tapones de ventilación están diseñados para su método de esterilización y requisitos de aplicación específicos.
-
Conozca los principios científicos de la esterilización en autoclave y cómo se utiliza el vapor saturado a presión para eliminar eficazmente los microorganismos. ↩
-
Explore el proceso químico de esterilización por óxido de etileno (ETO), un método de baja temperatura utilizado para esterilizar dispositivos médicos sensibles al calor y la humedad. ↩
-
Descubra los métodos utilizados para probar y validar la eficacia de una barrera microbiana, garantizando que impide la entrada de microorganismos y mantiene la esterilidad. ↩
-
Revise los requisitos clave de la norma ISO 11607, que especifica los materiales y las pruebas de los sistemas de barrera estéril para productos sanitarios. ↩
-
Comprender la reacción química de hidrólisis y cómo puede causar la degradación de ciertos materiales poliméricos cuando se exponen al agua o al vapor a altas temperaturas. ↩



