Fehler bei der Sterilisation von Medizinprodukten kosten die Hersteller jährlich Millionen, wobei 15-20% der Fehler auf eine unzureichende Entlüftung zurückzuführen sind, die ein ordnungsgemäßes Eindringen des Sterilisationsmittels verhindert. Standard-Belüftungsstopfen versagen unter Autoklav1 Temperaturen von 121-134°C oder zersetzen sich bei Einwirkung von Sterilisation mit Ethylenoxid (ETO)2 Chemikalien, was die Gewährleistung der Sterilität und die Einhaltung von Vorschriften beeinträchtigt.
Sterilisierbare Entlüftungsstopfen ermöglichen eine effektive Sterilisation, indem sie das Eindringen von Dampf oder ETO-Gas ermöglichen und gleichzeitig sterile Barrieren nach der Sterilisation aufrechterhalten. PTFE-Membranentlüftungen halten Autoklaventemperaturen von bis zu 150 °C stand und sind resistent gegen den chemischen Abbau durch ETO. Sie gewährleisten die zuverlässige Aufrechterhaltung der Sterilität von Medizinprodukten, pharmazeutischen Geräten und Laborinstrumenten, die validierte Sterilisationsprozesse erfordern.
Letztes Jahr arbeitete ich mit Dr. Sarah Mitchell, Qualitätsdirektorin bei einem führenden Hersteller von Medizinprodukten in Boston, zusammen, der bei der Sterilisationsvalidierung seiner Verpackungen für implantierbare Geräte Probleme hatte. Die standardmäßigen Entlüftungsstopfen aus Nylon schmolzen während der Autoklavierzyklen und verhinderten die korrekte Dampfdurchdringung. Nach der Umstellung auf unsere sterilisierbaren PTFE-Entlüftungsstopfen in pharmazeutischer Qualität mit validierter Temperaturbeständigkeit erreichte das Unternehmen eine Sterilisationseffizienz von 100% bei 1.000 Validierungszyklen - und damit die Einhaltung der FDA-Vorschriften und die Sicherheit der Patienten! 🏥
Inhaltsübersicht
- Was sind sterilisierbare Entlüftungsstopfen und warum sind sie so wichtig?
- Wie wirken sich unterschiedliche Sterilisationsmethoden auf die Materialien von Entlüftungsstopfen aus?
- Welche Materialien sind für die Sterilisation im Autoklaven am besten geeignet?
- Welche Materialien eignen sich am besten für ETO-Sterilisationsverfahren?
- Wie wählt man sterilisierbare Entlüftungsstopfen aus und validiert sie?
- FAQs über sterilisierbare Entlüftungsstopfen
Was sind sterilisierbare Entlüftungsstopfen und warum sind sie so wichtig?
Das Verständnis der Rolle sterilisierbarer Entlüftungsstopfen in der Herstellung von Medizinprodukten und Arzneimitteln ist für die Aufrechterhaltung der Sterilität und die Einhaltung gesetzlicher Vorschriften unerlässlich.
Sterilisierbare Entlüftungsstopfen sind spezielle atmungsaktive Entlüftungsöffnungen, die Sterilisationsprozessen standhalten und gleichzeitig das Eindringen von Sterilisationsmitteln ermöglichen und sterile Barrieren aufrechterhalten. Sie ermöglichen die Luftverdrängung während der Sterilisation, verhindern die Bildung eines Vakuums während der Abkühlung und sorgen für sterile Bedingungen nach der Sterilisation. Zu den kritischen Anwendungen gehören Verpackungen für medizinische Geräte, pharmazeutische Behälter, Laborgeräte und sterile Verarbeitungsanlagen.
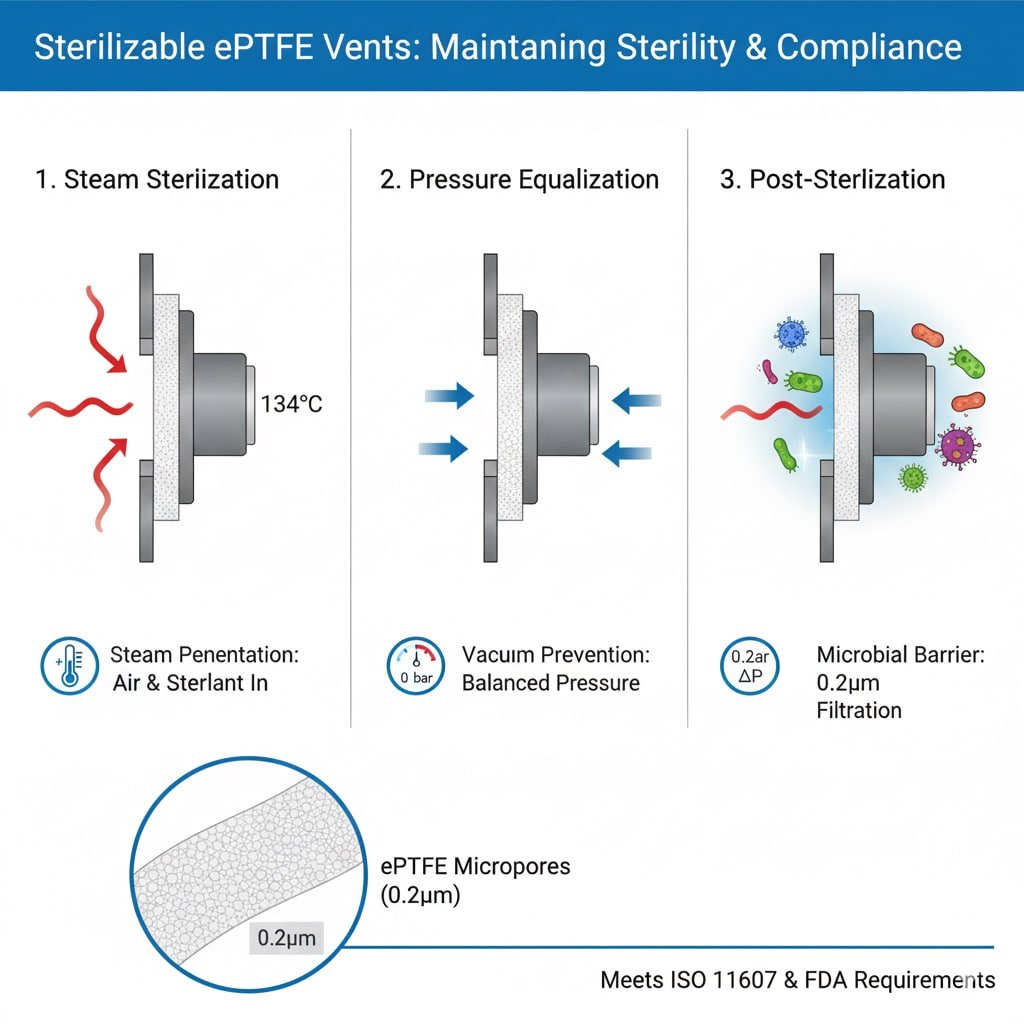
Anforderungen an den Sterilisationsprozess
Dampfdurchdringung: Bei der Sterilisation im Autoklaven muss der Dampf die Verpackung durchdringen und mit allen Oberflächen in Berührung kommen, so dass Entlüftungsöffnungen erforderlich sind, die einen Gasfluss ermöglichen und gleichzeitig mikrobielle Barrieren aufrechterhalten.
Luftverdrängung: Für eine wirksame Sterilisation muss die Luft vollständig entfernt und durch Sterilisiermittel ersetzt werden, was durch einen kontrollierten Gasaustausch erleichtert wird.
Druckausgleich: Sterilisationszyklen erzeugen Druckunterschiede, die von den Entlüftungsöffnungen ausgeglichen werden müssen, ohne die sterilen Barrieren oder die Verpackungsintegrität zu beeinträchtigen.
Kritische Leistungsparameter
Temperaturbeständigkeit: Sterilisierbare Entlüftungsöffnungen müssen ihre strukturelle Integrität und Filtrationsleistung bei Sterilisationstemperaturen von 121°C bis 150°C beibehalten.
Chemische Kompatibilität: Die Materialien müssen dem Abbau durch Sterilisationschemikalien wie Dampf, Ethylenoxid, Wasserstoffperoxid und Ozon widerstehen.
Effizienz der mikrobiellen Barriere: Nach der Sterilisation müssen die Entlüftungsöffnungen eine zuverlässige mikrobielle Barriere3 mit einer Porengröße von typischerweise 0,2-0,22 Mikrometern für die Rückhaltung von Bakterien.
Überlegungen zur Einhaltung gesetzlicher Vorschriften
FDA-Validierungsanforderungen: Anwendungen für medizinische Geräte erfordern validierte Sterilisationsprozesse mit dokumentierter Entlüftungsleistung während der gesamten Sterilisationszyklen.
Einhaltung der ISO-Normen: Sterilisierbare Entlüftungen müssen folgende Anforderungen erfüllen ISO 116074 Verpackungsnormen und die Anforderungen der ISO 17665 an die Dampfsterilisation für medizinische Anwendungen.
Biokompatibilitätstests: Bei Anwendungen mit Kontakt zu Medizinprodukten können Biokompatibilitätstests der USP-Klasse VI zur Gewährleistung der Patientensicherheit erforderlich sein.
Anwendungs-Kategorien
Verpackungen für medizinische Geräte: Sterilverpackungen für Implantate, chirurgische Instrumente und medizinische Einwegprodukte, die bis zum Gebrauch steril gehalten werden müssen.
Pharmazeutische Herstellung: Sterile Verarbeitungsgeräte, Bioreaktoren und pharmazeutische Behälter, die validierte Sterilisationsverfahren erfordern.
Laborausrüstung: Autoklavierbare Laborbehälter, Kulturgefäße und Analysegeräte, die für genaue Ergebnisse sterile Bedingungen erfordern.
Wie wirken sich unterschiedliche Sterilisationsmethoden auf die Materialien von Entlüftungsstopfen aus?
Unterschiedliche Sterilisationsverfahren stellen besondere Anforderungen an die Materialien von Entlüftungsstopfen, die für eine optimale Leistung spezifische Materialeigenschaften und Designüberlegungen erfordern.
Bei der Dampfsterilisation werden die Materialien hohen Temperaturen (121-134 °C) und gesättigtem Dampf ausgesetzt, was zu thermischem Abbau, Dimensionsänderungen und Membranschäden führen kann. Bei der ETO-Sterilisation werden die Materialien reaktiven Chemikalien bei niedrigeren Temperaturen (37-63 °C), aber längerer Einwirkungszeit ausgesetzt, was zu chemischem Abbau und Ausgasungen führen kann. Jedes Verfahren erfordert eine spezifische Materialauswahl für eine zuverlässige Leistung.
Auswirkungen der Dampfsterilisation
Thermische Belastung: Hohe Temperaturen bewirken eine thermische Ausdehnung, ein mögliches Schmelzen von thermoplastischen Bauteilen und eine Zersetzung von temperaturempfindlichen Materialien.
Hydrolyse-Reaktionen5: Die Einwirkung von Wasserdampf kann zu einem hydrolytischen Abbau bestimmter Polymere führen, insbesondere von Polyestern und einigen Polyamiden.
Dimensionsstabilität: Wiederholte thermische Zyklen können zu Dimensionsänderungen führen, die die Dichtungsleistung und die Filtrationseffizienz beeinträchtigen.
Herausforderungen bei der ETO-Sterilisation
Chemische Reaktivität: Ethylenoxid reagiert mit Materialien, die aktive Wasserstoffatome enthalten, wodurch sich die Materialeigenschaften verändern und giftige Rückstände entstehen können.
Anforderungen an die Ausgasung: ETO-sterilisierte Produkte erfordern eine längere Belüftungszeit, um absorbiertes ETO und Reaktionsprodukte vor der sicheren Verwendung zu entfernen.
Merkmale der Penetration: ETO erfordert bestimmte Feuchtigkeits- und Temperaturbedingungen für eine effektive Durchdringung, was sich auf die Anforderungen an die Entlüftung auswirkt.
Wasserstoffperoxid-Plasma-Effekte
Oxidative Zersetzung: H2O2-Plasma erzeugt hochreaktive Spezies, die organische Materialien durch Oxidationsreaktionen abbauen können.
Materialkompatibilität: Viele Elastomere und einige Kunststoffe sind mit der H2O2-Plasmasterilisation nicht kompatibel, da sie sich schnell zersetzen.
Vorteile bei niedrigen Temperaturen: Die Plasmasterilisation arbeitet bei niedrigen Temperaturen (45-55 °C), wodurch die thermische Belastung für temperaturempfindliche Materialien reduziert wird.
Überlegungen zur Gammastrahlung
Strahlenschäden: Hochenergetische Gammastrahlung kann zur Spaltung oder Vernetzung von Polymerketten führen, wodurch sich die Materialeigenschaften erheblich verändern.
Dosisakkumulation: Wiederholte Gammasterilisation kann zu kumulativen Schäden führen, wodurch die Anzahl der Sterilisationszyklen, denen die Materialien standhalten können, begrenzt wird.
Bedarf an Antioxidantien: Strahlenresistente Formulierungen erfordern häufig Antioxidantien, um den oxidativen Abbau während und nach der Bestrahlung zu verhindern.
Kürzlich half ich Ahmed Al-Rashid, Betriebsleiter einer pharmazeutischen Einrichtung in Dubai, bei der Lösung von ETO-Sterilisationsvalidierungsproblemen mit den Entlüftungssystemen ihrer Bioreaktoren. Die standardmäßigen Entlüftungsstopfen absorbierten ETO und erforderten verlängerte 14-tägige Belüftungszeiten, was die Produktionspläne störte. Durch den Einsatz unserer ETO-kompatiblen PTFE-Entlüftungsstopfen mit minimalen Absorptionseigenschaften konnte die Belüftungszeit auf 24 Stunden reduziert werden, wobei die Sterilität vollständig gewährleistet blieb - eine erhebliche Verbesserung der Produktionseffizienz! 🚀
Welche Materialien sind für die Sterilisation im Autoklaven am besten geeignet?
Die Auswahl geeigneter Materialien für die Sterilisation im Autoklaven erfordert Kenntnisse über die thermische Stabilität, die Hydrolysebeständigkeit und die Langzeitleistung bei wiederholter Dampfeinwirkung.
PTFE (Polytetrafluorethylen) bietet eine überragende Autoklavleistung mit Dauergebrauchstemperaturen bis 260°C, ausgezeichnete chemische Inertheit und Hydrolysebeständigkeit. PVDF (Polyvinylidenfluorid) bietet eine gute thermische Stabilität bis 150°C bei geringeren Kosten. Vermeiden Sie Nylon, Standard-Polyethylen und die meisten Elastomere, die sich unter Autoklavierbedingungen zersetzen und die Filtrations- und Dichtungsleistung beeinträchtigen.
Vorteile von PTFE-Membranen
Außergewöhnliche Temperaturbeständigkeit: PTFE behält seine strukturelle Integrität und Filtrationsleistung bei Temperaturen, die weit über den typischen Autoklavbedingungen (121-134°C) liegen.
Chemische Trägheit: PTFE widersteht dem Abbau durch Dampf, Reinigungschemikalien und Sterilisationsnebenprodukte und gewährleistet eine gleichbleibende Langzeitleistung.
Hydrophobe Eigenschaften: Die hydrophobe Beschaffenheit von PTFE verhindert die Wasseraufnahme und bewahrt die Formstabilität während der Sterilisationszyklen.
Vergleich der Materialleistung
| Material | Maximale Temperatur (°C) | Dampfbeständigkeit | Hydrolysebeständigkeit | Kostenfaktor |
|---|---|---|---|---|
| PTFE | 260 | Ausgezeichnet | Ausgezeichnet | Hoch |
| PVDF | 150 | Gut | Gut | Mittel |
| PP (Polypropylen) | 135 | Messe | Messe | Niedrig |
| Nylon | 80-100 | Schlecht | Schlecht | Niedrig |
Auswahl des Gehäusematerials
Rostfreier Stahl 316L: Bietet eine hervorragende Korrosionsbeständigkeit, thermische Stabilität und Reinigungsfähigkeit für pharmazeutische und medizinische Anwendungen, die validierte Reinigungsverfahren erfordern.
PEEK (Polyetheretherketon): Bietet eine hervorragende thermische Stabilität (Dauereinsatz bis 250°C) mit ausgezeichneter chemischer Beständigkeit für anspruchsvolle Autoklavenanwendungen.
Polypropylen: Kostengünstige Option für Einweganwendungen mit ausreichender Leistung für Standard-Autoklavenzyklen bei 121°C.
Überlegungen zu Dichtungskomponenten
EPDM-O-Ringe: Sie bieten eine gute Dampfbeständigkeit und thermische Stabilität bei Temperaturen bis zu 150°C und eine hervorragende Dichtungsleistung.
Silikondichtungen: Sie bieten eine überragende Temperaturbeständigkeit (bis zu 200 °C), können aber Probleme mit der Kompatibilität mit bestimmten Reinigungschemikalien haben.
PTFE-gekapselte O-Ringe: Kombinieren Sie die chemische Beständigkeit von PTFE mit den Dichtungseigenschaften von Elastomeren für anspruchsvolle Anwendungen, die beide Leistungsmerkmale erfordern.
Design-Optimierung für den Einsatz im Autoklaven
Thermische Ausdehnung Unterkunft: Entlüftungskonstruktionen müssen die unterschiedliche Wärmeausdehnung der Materialien berücksichtigen, um ein Versagen der Dichtung bei Temperaturschwankungen zu verhindern.
Entwässerungsmerkmale: Eine ordnungsgemäße Entwässerung verhindert die Ansammlung von Kondensat, das die Filterleistung beeinträchtigen oder Verschmutzungsrisiken verursachen könnte.
Unterstützung bei der Validierung: Die Konstruktionsmerkmale sollten Validierungstests einschließlich Druckabfall, mikrobieller Belastung und Überprüfung der thermischen Leistung erleichtern.
Welche Materialien eignen sich am besten für ETO-Sterilisationsverfahren?
Die ETO-Sterilisation stellt besondere Anforderungen an die Materialien, die für eine effiziente Verarbeitung chemische Kompatibilität, minimale Absorption und schnelle Ausgasungseigenschaften aufweisen müssen.
PTFE und PVDF bieten eine ausgezeichnete ETO-Kompatibilität mit minimaler chemischer Absorption und schneller Ausgasung. Vermeiden Sie Materialien mit aktiven Wasserstoffstellen wie Nylon, PVC und Naturkautschuk, die mit ETO unter Bildung giftiger Verbindungen reagieren. Edelstahlgehäuse bieten optimale chemische Beständigkeit, während Silikondichtungen eine gute ETO-Kompatibilität mit akzeptablen Ausgasungseigenschaften für die meisten Anwendungen bieten.
ETO Chemische Kompatibilität
Reaktionsmechanismen: ETO reagiert mit Materialien, die Hydroxyl-, Amino-, Carboxyl- und Sulfhydrylgruppen enthalten, wobei Ethylenglykolderivate und andere potenziell toxische Verbindungen entstehen.
Absorptionseigenschaften: Materialien mit hoher ETO-Absorption erfordern längere Belüftungszeiten, was die Verarbeitungszeit und die Kosten erheblich erhöht.
Ausgasungskinetik: Schnell ausgasende Materialien ermöglichen kürzere Belüftungszyklen, verbessern die Prozesseffizienz und reduzieren die Lagerhaltungszeiten.
Material ETO Performance Rankings
Ausgezeichnete ETO-Kompatibilität:
- PTFE: Minimale Absorption, schnelle Ausgasung, keine chemische Reaktivität
- PVDF: Geringe Absorption, gute Ausgasung, ausgezeichnete chemische Beständigkeit
- Rostfreier Stahl: Keine Absorption, sofortige Einsatzfähigkeit
Gute ETO-Kompatibilität:
- Polypropylen: Mäßige Absorption, akzeptable Ausgasung
- Silikone: Geringe Reaktivität, mäßige Ausgasungsanforderungen
Schlechte ETO-Kompatibilität:
- Nylon: Hohe Reaktivität, längere Belüftung erforderlich
- PVC: Chemische Zersetzung, Bildung toxischer Verbindungen
- Naturkautschuk: Hohe Absorption, potenzielle Zersetzung
Anforderungen an die Belüftungszeit
| Material | Typische Belüftungszeit | ETO-Absorptionsgrad | Ausgasungsrate |
|---|---|---|---|
| PTFE | 8-24 Stunden | Minimal | Schnell |
| PVDF | 24-48 Stunden | Niedrig | Gut |
| Polypropylen | 48-72 Stunden | Mäßig | Mäßig |
| Nylon | 7-14 Tage | Hoch | Langsam |
Optimierung der Prozessparameter
Temperaturkontrolle: Die ETO-Sterilisation erfolgt in der Regel bei 37-63 °C und erfordert Materialien, die in diesem Temperaturbereich leistungsfähig sind.
Anforderungen an die Luftfeuchtigkeit: Für die Wirksamkeit von ETO ist eine relative Luftfeuchtigkeit von 40-80% erforderlich, so dass Materialien benötigt werden, die unter diesen Feuchtigkeitsbedingungen beständig funktionieren.
Management der Gaskonzentration: ETO-Konzentrationen von 450-1200 mg/L erfordern Materialien, die chemischen Angriffen widerstehen und gleichzeitig das Eindringen von Sterilisationsmitteln ermöglichen.
Überlegungen zur Validierung
Rückstandstests: ETO-sterilisierte Produkte müssen auf ETO-Rückstände und Reaktionsprodukte untersucht werden, um die Einhaltung der Sicherheitsgrenzen zu gewährleisten.
Aufrechterhaltung der Biokompatibilität: Die Materialien müssen ihre Biokompatibilität auch nach der ETO-Exposition und Belüftung beibehalten, was eine validierte Materialauswahl erfordert.
Prozessüberwachung: Die ETO-Sterilisation erfordert eine kontinuierliche Überwachung von Temperatur, Feuchtigkeit, Druck und Gaskonzentration während des gesamten Zyklus.
Wie wählt man sterilisierbare Entlüftungsstopfen aus und validiert sie?
Die richtige Auswahl und Validierung sterilisierbarer Entlüftungsstopfen gewährleistet eine zuverlässige Sterilisationsleistung, die Einhaltung gesetzlicher Vorschriften und langfristigen betrieblichen Erfolg.
Die Auswahl erfordert die Abstimmung der Materialeigenschaften auf das Sterilisationsverfahren, die Festlegung der Leistungsanforderungen und die Berücksichtigung der gesetzlichen Normen. Die Validierung umfasst thermische Leistungstests, Studien zur mikrobiellen Belastung, Beurteilung der chemischen Kompatibilität und Bewertung der Langzeitstabilität. Dokumentieren Sie alle Tests gemäß den FDA- und ISO-Normen für die Vorlage bei den Behörden und die Einhaltung des Qualitätssystems.
Rahmen für die Auswahlkriterien
Kompatibilität der Sterilisationsmethode: Anpassung von Entlüftungsmaterialien an spezifische Sterilisationsverfahren (Dampf, ETO, H2O2-Plasma, Gamma) auf der Grundlage der Anforderungen an Temperatur, Chemikalien- und Strahlungsbeständigkeit.
Leistungsspezifikationen: Definieren Sie die erforderlichen Durchflussraten, Druckstufen, Filtrationseffizienz und mikrobiellen Barriereeigenschaften auf der Grundlage der Anwendungsanforderungen.
Regulatorische Anforderungen: Berücksichtigen Sie die FDA-Geräteklassifizierung, die Einhaltung der ISO-Normen und die Biokompatibilitätsanforderungen für die vorgesehenen Anwendungen.
Parameter für die Anwendungsbewertung
Betriebsumgebung: Bewertung von Temperaturbereichen, chemischer Belastung, Druckbedingungen und Kontaminationsrisiken während des gesamten Produktlebenszyklus.
Häufigkeit der Sterilisation: Berücksichtigen Sie den einmaligen Gebrauch gegenüber mehreren Sterilisationszyklen und die kumulativen Auswirkungen auf die Leistung und Zuverlässigkeit des Materials.
Umfang der Validierung: Bestimmung der Prüfanforderungen auf der Grundlage der Risikobewertung, der gesetzlichen Vorgaben und der Anforderungen des Qualitätssystems.
Protokoll für Validierungstests
Prüfung der thermischen Leistung:
- Temperaturwechsel unter Sterilisationsbedingungen
- Messung der Dimensionsstabilität
- Überprüfung der Filtrationseffizienz nach thermischer Belastung
Mikrobielle Belastungstests:
- Bakterielle Herausforderung mit geeigneten Testorganismen
- Überprüfung der Sterilitätserhaltung
- Bewertung der langfristigen Integrität von Barrieren
Bewertung der chemischen Verträglichkeit:
- Bewertung der Materialverschlechterung
- Prüfung auf extrahierbare und auslaugbare Stoffe
- Überprüfung der Biokompatibilität
Anforderungen an die Dokumentation
Material-Spezifikationen: Vollständige Materialdatenblätter mit chemischer Zusammensetzung, thermischen Eigenschaften und behördlichen Zertifizierungen.
Testprotokolle: Detaillierte Validierungsprotokolle gemäß FDA-Richtlinien und ISO-Normen für die Sterilisationsvalidierung.
Leistungsdaten: Umfassende Testergebnisse, die die Leistung unter den angegebenen Betriebsbedingungen und Sterilisationszyklen belegen.
Integration des Qualitätssystems
Lieferantenqualifizierung: Festlegung von Qualitätsvereinbarungen mit Zulieferern, einschließlich Materialrückverfolgbarkeit, Änderungskontrolle und Anforderungen an die Qualitätsdokumentation.
Eingehende Inspektion: Entwicklung von Inspektionsverfahren für kritische Abmessungen, Materialeigenschaften und die Überprüfung von Leistungsmerkmalen.
Prozess-Validierung: Integrieren Sie die Entlüftungsleistung in die Validierung des gesamten Sterilisationsprozesses, einschließlich Tests für den schlimmsten Fall.
Überlegungen zum Risikomanagement
Fehlermöglichkeitsanalyse: Identifizierung potenzieller Fehlermodi, einschließlich Materialverschlechterung, Dichtungsversagen und Filtrationsbeeinträchtigung mit entsprechenden Abhilfestrategien.
Kontrolle ändern: Festlegung von Verfahren zur Verwaltung von Materialänderungen, Lieferantenänderungen und Spezifikationsänderungen mit entsprechenden Revalidierungsanforderungen.
Kontinuierliche Überwachung: Implementieren Sie laufende Überwachungsprogramme, um die kontinuierliche Leistung zu überprüfen und potenzielle Probleme zu erkennen, bevor sie die Produktqualität beeinträchtigen.
Schlussfolgerung
Sterilisierbare Entlüftungsstopfen spielen eine entscheidende Rolle bei der Sicherstellung einer effektiven Sterilisation und der Aufrechterhaltung steriler Barrieren in medizinischen Geräten und pharmazeutischen Anwendungen. Das Verständnis der einzigartigen Herausforderungen verschiedener Sterilisationsmethoden und die Auswahl geeigneter Materialien sind entscheidend für eine zuverlässige Leistung und die Einhaltung gesetzlicher Vorschriften.
Entlüftungsstopfen auf PTFE-Basis bieten eine hervorragende Leistung bei verschiedenen Sterilisationsverfahren und zeichnen sich durch hervorragende Temperaturbeständigkeit, chemische Kompatibilität und langfristige Zuverlässigkeit aus. Die richtige Auswahl und Validierung gewährleisten eine optimale Sterilisationseffektivität bei gleichzeitiger Minimierung von Verarbeitungszeit und Kosten.
Bepto bietet ein umfassendes Sortiment an sterilisierbaren Entlüftungsstopfen mit PTFE-Membranen in pharmazeutischer Qualität, validierter Temperaturleistung und vollständigen Dokumentationspaketen für die Einreichung von Zulassungsanträgen. Mit mehr als einem Jahrzehnt Erfahrung in spezialisierten Entlüftungsanwendungen und ISO-zertifizierten Fertigungskapazitäten bieten wir die zuverlässigen, kostengünstigen Lösungen, die Sie für kritische Sterilisationsanwendungen benötigen. Vertrauen Sie uns, wenn es um die Validierung Ihrer Sterilisationsprozesse und die Sicherheit Ihrer Produkte geht! 🔬
FAQs über sterilisierbare Entlüftungsstopfen
F: Kann derselbe Entlüftungsstopfen sowohl für die Autoklav- als auch für die ETO-Sterilisation verwendet werden?
A: Ja, Entlüftungsstopfen aus PTFE-Membranen sind sowohl für die Sterilisation im Autoklaven als auch für die ETO-Sterilisation geeignet. PTFE bietet eine ausgezeichnete Temperaturbeständigkeit für Autoklavenzyklen und eine minimale ETO-Absorption für eine schnelle Belüftung, was es ideal für Einrichtungen macht, die mehrere Sterilisationsmethoden anwenden.
F: Wie viele Sterilisationszyklen kann ein Entlüftungsstopfen überstehen?
A: Hochwertige PTFE-Entlüftungsstopfen halten in der Regel 100+ Autoklavenzyklen oder 50+ ETO-Zyklen stand und behalten dabei ihre Filtrationsleistung bei. Die tatsächliche Zyklusdauer hängt von den Sterilisationsparametern, den Handhabungsverfahren und den Leistungskriterien für Ihre spezifische Anwendung ab.
F: Welche Porengröße ist für die Sterilfiltration in medizinischen Anwendungen erforderlich?
A: Medizinische Anwendungen erfordern in der Regel eine Porengröße von 0,2 oder 0,22 Mikron, um Bakterien zuverlässig zurückzuhalten. Diese Porengröße bietet eine validierte Sterilitätsgarantie und ermöglicht gleichzeitig einen angemessenen Gasfluss für eine effektive Sterilisation und einen Druckausgleich.
F: Erfordern sterilisierbare Entlüftungsstopfen spezielle Validierungstests?
A: Ja, sterilisierbare Entlüftungsstopfen erfordern Validierungstests, einschließlich Studien zur thermischen Leistung, zur mikrobiellen Belastung und zur Materialverträglichkeit. Die Tests müssen gemäß den FDA-Richtlinien und ISO-Normen durchgeführt werden, wobei die Dokumentation die Validierung des Sterilisationsprozesses und die Einreichung bei den Behörden unterstützen muss.
F: Wie verhindert man die Kontamination von Entlüftungsstopfen während der Sterilisation?
A: Verhindern Sie eine Kontamination durch ordnungsgemäße Installation, Schutzabdeckungen während der Handhabung, validierte Sterilisationsparameter und geeignete Lagerung nach der Sterilisation. Wenden Sie bei der Installation sterile Techniken an und stellen Sie sicher, dass die Entlüftungsstopfen für Ihr spezielles Sterilisationsverfahren und Ihre Anwendungsanforderungen geeignet sind.
-
Lernen Sie die wissenschaftlichen Grundsätze der Sterilisation im Autoklaven kennen und erfahren Sie, wie gesättigter Dampf unter Druck zur wirksamen Abtötung von Mikroorganismen eingesetzt wird. ↩
-
Erforschen Sie den chemischen Prozess der Ethylenoxid-Sterilisation (ETO), ein Niedrigtemperaturverfahren, das zur Sterilisation von wärme- und feuchtigkeitsempfindlichen medizinischen Geräten eingesetzt wird. ↩
-
Entdecken Sie die Methoden zur Prüfung und Validierung der Wirksamkeit einer mikrobiellen Barriere, die das Eindringen von Mikroorganismen verhindert und die Sterilität aufrechterhält. ↩
-
Überprüfen Sie die wichtigsten Anforderungen der Norm ISO 11607, in der die Materialien und Prüfungen für sterile Barrieresysteme für Medizinprodukte festgelegt sind. ↩
-
die chemische Reaktion der Hydrolyse zu verstehen und zu verstehen, wie sie den Abbau bestimmter Polymermaterialien verursachen kann, wenn sie Wasser oder Dampf bei hohen Temperaturen ausgesetzt werden. ↩



