Fejl ved sterilisering af medicinsk udstyr koster producenterne millioner af kroner hvert år, og 15-20% af fejlene tilskrives utilstrækkelig udluftning, som forhindrer steriliseringsmidlet i at trænge ordentligt ind. Standard udluftningspropper fejler under Autoklave1 temperaturer på 121-134°C eller nedbrydes, når de udsættes for sterilisering med ethylenoxid (ETO)2 kemikalier, hvilket kompromitterer sterilitetssikring og overholdelse af lovgivningen.
Steriliserbare udluftningspropper muliggør effektiv sterilisering ved at tillade damp- eller ETO-gasindtrængning og samtidig opretholde sterile barrierer efter sterilisering. PTFE-membranventiler tåler autoklavetemperaturer på op til 150 °C og modstår kemisk nedbrydning af ETO, hvilket sikrer pålidelig vedligeholdelse af sterilitet for medicinsk udstyr, farmaceutisk udstyr og laboratorieinstrumenter, der kræver validerede steriliseringsprocesser.
Sidste år arbejdede jeg sammen med Dr. Sarah Mitchell, kvalitetsdirektør hos en førende producent af medicinsk udstyr i Boston, som oplevede fejl i steriliseringsvalideringen af deres emballage til implanterbart udstyr. Deres standard udluftningspropper af nylon smeltede under autoklavecyklusser og blokerede for korrekt dampgennemtrængning. Efter at have skiftet til vores steriliserbare PTFE-udluftningspropper af farmaceutisk kvalitet med valideret temperaturbestandighed opnåede de 100%-steriliseringseffektivitet på tværs af 1.000 valideringscyklusser - hvilket sikrer FDA-overholdelse og patientsikkerhed! 🏥
Indholdsfortegnelse
- Hvad er steriliserbare udluftningspropper, og hvorfor er de vigtige?
- Hvordan påvirker forskellige steriliseringsmetoder materialer til udluftningspropper?
- Hvilke materialer er bedst til autoklav-sterilisering?
- Hvilke materialer fungerer bedst til ETO-steriliseringsprocesser?
- Hvordan vælger og validerer du steriliserbare udluftningspropper?
- Ofte stillede spørgsmål om steriliserbare udluftningspropper
Hvad er steriliserbare udluftningspropper, og hvorfor er de vigtige?
Det er vigtigt at forstå den rolle, som steriliserbare udluftningspropper spiller i produktionen af medicinsk udstyr og lægemidler, hvis man vil sikre sterilitet og overholde lovgivningen.
Steriliserbare ventilationspropper er specialiserede åndbare ventilationsåbninger, der er designet til at modstå steriliseringsprocesser, samtidig med at de tillader indtrængning af steriliseringsmidler og opretholder sterile barrierer. De muliggør luftfortrængning under sterilisering, forhindrer vakuumdannelse under afkøling og opretholder sterile forhold efter sterilisering. Kritiske anvendelser omfatter emballage til medicinsk udstyr, farmaceutiske beholdere, laboratorieudstyr og sterilt behandlingsudstyr.
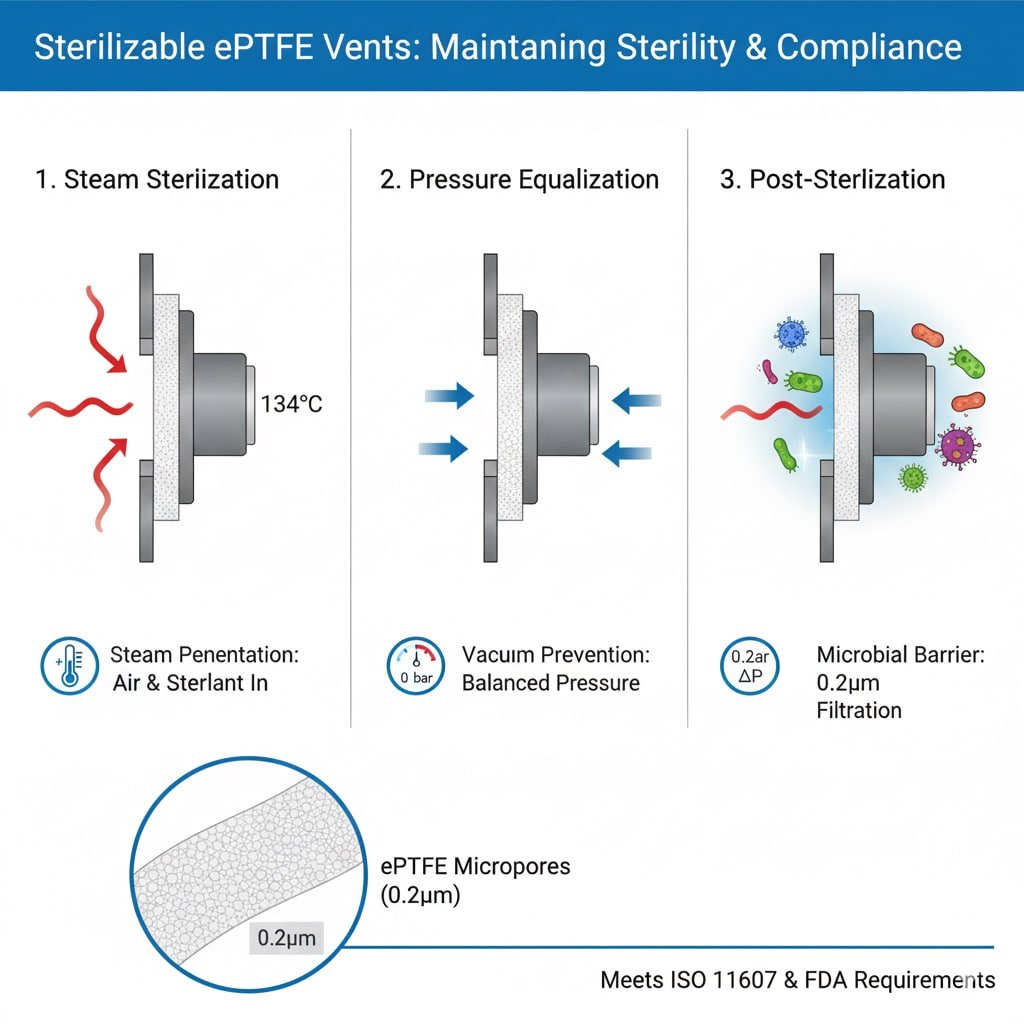
Krav til steriliseringsprocessen
Dampgennemtrængning: Autoklavesterilisering kræver, at damp trænger ind i emballagen og kommer i kontakt med alle overflader, hvilket kræver ventilationsåbninger, der tillader gasflow og samtidig opretholder mikrobielle barrierer.
Luftfortrængning: Effektiv sterilisering kræver fuldstændig fjernelse af luft og udskiftning med steriliseringsmiddel, hvilket ventilationsåbninger muliggør gennem kontrolleret gasudveksling.
Trykudligning: Steriliseringscyklusser skaber trykforskelle, som ventilationsåbninger skal kunne rumme uden at kompromittere sterile barrierer eller pakkens integritet.
Kritiske præstationsparametre
Temperaturbestandighed: Steriliserbare ventilationsåbninger skal bevare strukturel integritet og filtreringsevne ved steriliseringstemperaturer fra 121 °C til 150 °C.
Kemisk kompatibilitet: Materialerne skal kunne modstå nedbrydning fra steriliseringskemikalier, herunder damp, ethylenoxid, hydrogenperoxid og ozon.
Mikrobiel barriereeffektivitet: Efter sterilisering skal ventilationsåbninger give en pålidelig mikrobiel barriere3 med porestørrelser på typisk 0,2-0,22 mikrometer til tilbageholdelse af bakterier.
Overvejelser om overholdelse af lovgivningen
FDA's krav til validering: Anvendelser af medicinsk udstyr kræver validerede steriliseringsprocesser med dokumenteret ventilationsydelse gennem hele steriliseringscyklussen.
Overholdelse af ISO-standarder: Steriliserbare ventilationsåbninger skal opfylde ISO 116074 emballagestandarder og ISO 17665 dampsteriliseringskrav til medicinske anvendelser.
Test af biokompatibilitet: Anvendelser med kontakt til medicinsk udstyr kan kræve USP Class VI-biokompatibilitetstest for at sikre patientsikkerheden.
Applikationskategorier
Emballage til medicinsk udstyr: Steril emballage til implantater, kirurgiske instrumenter og medicinsk engangsudstyr, der kræver opretholdelse af sterilitet indtil brug.
Farmaceutisk produktion: Sterilt procesudstyr, bioreaktorer og farmaceutiske beholdere, der kræver validerede steriliseringsprocesser.
Laboratorieudstyr: Autoklaverbare laboratoriebeholdere, dyrkningsbeholdere og analyseudstyr, der kræver sterile forhold for at give nøjagtige resultater.
Hvordan påvirker forskellige steriliseringsmetoder materialer til udluftningspropper?
Forskellige steriliseringsmetoder skaber unikke udfordringer for materialer til udluftningspropper, hvilket kræver specifikke materialeegenskaber og designovervejelser for at opnå optimal ydeevne.
Dampsterilisering udsætter materialer for høje temperaturer (121-134 °C) og mættet damp, der kan forårsage termisk nedbrydning, dimensionsændringer og membranskader. ETO-sterilisering udsætter materialer for reaktive kemikalier ved lavere temperaturer (37-63 °C), men længere eksponeringstider, der kan forårsage kemisk nedbrydning og afgasning. Hver metode kræver et specifikt materialevalg for at sikre pålidelig ydeevne.
Effekter af dampsterilisering
Termisk stress: Høje temperaturer medfører termisk udvidelse, potentiel smeltning af termoplastiske komponenter og nedbrydning af temperaturfølsomme materialer.
Hydrolyse-reaktioner5: Dampeksponering kan forårsage hydrolytisk nedbrydning af visse polymerer, især polyestere og visse polyamider.
Dimensionel stabilitet: Gentagen termisk cykling kan forårsage dimensionsændringer, der påvirker tætningsevnen og filtreringseffektiviteten.
Udfordringer ved ETO-sterilisering
Kemisk reaktivitet: Ethylenoxid reagerer med materialer, der indeholder aktive brintatomer, hvilket potentielt kan ændre materialets egenskaber og skabe giftige rester.
Krav til afgasning: ETO-steriliserede produkter kræver længerevarende luftningsperioder for at fjerne absorberet ETO og reaktionsprodukter før sikker brug.
Gennemtrængningsegenskaber: ETO kræver specifikke fugtigheds- og temperaturforhold for at trænge effektivt ind, hvilket påvirker kravene til ventilationsdesign.
Hydrogenperoxid-plasmaeffekter
Oxidativ nedbrydning: H2O2-plasma skaber meget reaktive arter, der kan nedbryde organiske materialer gennem oxidationsreaktioner.
Materialekompatibilitet: Mange elastomerer og nogle plastmaterialer er uforenelige med H2O2-plasmasterilisering på grund af hurtig nedbrydning.
Fordele ved lav temperatur: Plasmasterilisering foregår ved lave temperaturer (45-55 °C), hvilket reducerer den termiske belastning på temperaturfølsomme materialer.
Overvejelser om gammastråling
Strålingsskader: Højenergisk gammastråling kan forårsage spaltning eller tværbinding af polymerkæder og dermed ændre materialets egenskaber markant.
Akkumulering af doser: Gentagen gammasterilisering kan forårsage kumulativ skade, hvilket begrænser antallet af steriliseringscyklusser, som materialerne kan tåle.
Behov for antioxidanter: Strålingsresistente formuleringer kræver ofte antioxidanter for at forhindre oxidativ nedbrydning under og efter bestråling.
For nylig hjalp jeg Ahmed Al-Rashid, driftschef på et farmaceutisk anlæg i Dubai, med at løse problemer med validering af ETO-sterilisering med deres bioreaktorudluftningssystemer. Deres standardudluftningspropper absorberede ETO og krævede forlængede 14-dages luftningsperioder, som forstyrrede produktionsplanerne. Ved at implementere vores ETO-kompatible PTFE-udluftningspropper med minimale absorptionsegenskaber reducerede de beluftningstiden til 24 timer, samtidig med at de opretholdt fuld sterilitetssikring - hvilket dramatisk forbedrede produktionseffektiviteten! 🚀
Hvilke materialer er bedst til autoklav-sterilisering?
Valg af egnede materialer til autoklavesterilisering kræver forståelse af termisk stabilitet, hydrolysebestandighed og langsigtet ydeevne under gentagen eksponering for damp.
PTFE (polytetrafluorethylen) giver overlegen autoklaveydelse med kontinuerlige driftstemperaturer på op til 260 °C, fremragende kemisk inerti og hydrolysebestandighed. PVDF (polyvinylidenfluorid) giver god termisk stabilitet op til 150 °C til en lavere pris. Undgå nylon, standardpolyethylen og de fleste elastomerer, der nedbrydes under autoklaveforhold og forringer filtrerings- og forseglingsevnen.
Fordele ved PTFE-membraner
Ekstraordinær temperaturbestandighed: PTFE opretholder strukturel integritet og filtreringsydelse ved temperaturer langt over typiske autoklaveforhold (121-134 °C).
Kemisk inerti: PTFE modstår nedbrydning fra damp, rengøringskemikalier og biprodukter fra sterilisering, hvilket sikrer en ensartet ydelse på lang sigt.
Hydrofobe egenskaber: PTFE's hydrofobe natur forhindrer vandabsorption og opretholder dimensionsstabilitet gennem steriliseringscyklusser.
Sammenligning af materialers ydeevne
| Materiale | Maks. temperatur (°C) | Dampmodstand | Modstandsdygtighed over for hydrolyse | Omkostningsfaktor |
|---|---|---|---|---|
| PTFE | 260 | Fremragende | Fremragende | Høj |
| PVDF | 150 | God | God | Medium |
| PP (polypropylen) | 135 | Fair | Fair | Lav |
| Nylon | 80-100 | Dårlig | Dårlig | Lav |
Valg af materiale til huset
Rustfrit stål 316L: Giver fremragende korrosionsbestandighed, termisk stabilitet og rengøringsvenlighed til farmaceutiske og medicinske anvendelser, der kræver validerede rengøringsprocedurer.
PEEK (polyetheretherketon): Giver enestående termisk stabilitet (kontinuerlig brug op til 250 °C) med fremragende kemisk resistens til krævende autoklaveopgaver.
Polypropylen: Omkostningseffektiv løsning til engangsbrug med tilstrækkelig ydeevne til standard autoklavecyklusser ved 121 °C.
Overvejelser om forseglingskomponenter
EPDM O-ringe: Giver god dampmodstand og termisk stabilitet ved temperaturer op til 150 °C med fremragende forseglingsevne.
Silikoneforseglinger: Giver overlegen temperaturbestandighed (op til 200 °C), men kan have kompatibilitetsproblemer med visse rengøringskemikalier.
PTFE-indkapslede O-ringe: Kombiner PTFE's kemiske modstandsdygtighed med elastomerens tætningsegenskaber til krævende anvendelser, der kræver begge egenskaber.
Designoptimering til brug i autoklaver
Termisk ekspansion Indkvartering: Udluftningsdesignet skal tage højde for forskellig varmeudvidelse mellem materialerne for at forhindre, at forseglingen svigter under temperaturskift.
Afvandingsfunktioner: Korrekt drændesign forhindrer ophobning af kondensvand, der kan kompromittere filtreringsevnen eller skabe risiko for kontaminering.
Støtte til validering: Designfunktioner skal lette valideringstest, herunder trykfald, mikrobiel udfordring og verifikation af termisk ydeevne.
Hvilke materialer fungerer bedst til ETO-steriliseringsprocesser?
ETO-sterilisering giver unikke materialeudfordringer, der kræver kemisk kompatibilitet, minimal absorption og hurtige afgasningsegenskaber for effektiv behandling.
PTFE og PVDF giver fremragende ETO-kompatibilitet med minimal kemisk absorption og hurtig afgasning. Undgå materialer med aktive brintsider som nylon, PVC og naturgummi, der reagerer med ETO og danner giftige forbindelser. Hus af rustfrit stål giver optimal kemisk modstandsdygtighed, mens silikonepakninger giver god ETO-kompatibilitet med acceptable afgasningsegenskaber til de fleste anvendelser.
ETO's kemiske kompatibilitet
Reaktionsmekanismer: ETO reagerer med materialer, der indeholder hydroxyl-, amino-, carboxyl- og sulfhydrylgrupper, og danner ethylenglykolderivater og andre potentielt giftige forbindelser.
Absorptionsegenskaber: Materialer med høj ETO-absorption kræver længere beluftningsperioder, hvilket øger behandlingstiden og omkostningerne betydeligt.
Kinetik for afgasning: Hurtigt afgasende materialer muliggør kortere beluftningscyklusser, hvilket forbedrer proceseffektiviteten og reducerer lagerbeholdningen.
Placering af materiale i ETO Performance
Fremragende ETO-kompatibilitet:
- PTFE: Minimal absorption, hurtig afgasning, ingen kemisk reaktivitet
- PVDF: Lav absorption, god afgasning, fremragende kemisk resistens
- Rustfrit stål: Ingen absorption, kan bruges med det samme
God ETO-kompatibilitet:
- Polypropylen: Moderat absorption, acceptabel afgasning
- Silikone: Lav reaktivitet, moderate krav til afgasning
Dårlig ETO-kompatibilitet:
- Nylon: Høj reaktivitet, kræver længere tids udluftning
- PVC: Kemisk nedbrydning, dannelse af giftige forbindelser
- Naturgummi: Høj absorption, potentiel nedbrydning
Krav til beluftningstid
| Materiale | Typisk beluftningstid | ETO-absorptionsniveau | Afgasningshastighed |
|---|---|---|---|
| PTFE | 8-24 timer | Minimal | Hurtig |
| PVDF | 24-48 timer | Lav | God |
| Polypropylen | 48-72 timer | Moderat | Moderat |
| Nylon | 7-14 dage | Høj | Langsomt |
Optimering af procesparametre
Temperaturkontrol: ETO-sterilisering foregår typisk ved 37-63 °C, og det kræver materialer, der kan holde hele dette temperaturområde.
Krav til luftfugtighed: ETO-effektivitet kræver 40-80% relativ luftfugtighed, hvilket kræver materialer, der fungerer konsekvent under disse fugtforhold.
Håndtering af gaskoncentration: ETO-koncentrationer på 450-1200 mg/L kræver materialer, der modstår kemiske angreb, samtidig med at steriliseringsmidlet kan trænge ind.
Overvejelser om validering
Test af restkoncentrationer: ETO-steriliserede produkter skal testes for ETO-rester og reaktionsprodukter for at sikre, at sikkerhedsgrænserne overholdes.
Vedligeholdelse af biokompatibilitet: Materialerne skal bevare deres biokompatibilitet efter ETO-eksponering og beluftning, hvilket kræver valideret materialevalg.
Overvågning af processer: ETO-sterilisering kræver kontinuerlig overvågning af temperatur, luftfugtighed, tryk og gaskoncentration under hele cyklussen.
Hvordan vælger og validerer du steriliserbare udluftningspropper?
Korrekt valg og validering af steriliserbare udluftningspropper sikrer pålidelig steriliseringsydelse, overholdelse af lovgivningen og langsigtet driftssucces.
Udvælgelse kræver, at man matcher materialets egenskaber med steriliseringsmetoden, definerer krav til ydeevne og overvejer lovmæssige standarder. Validering omfatter test af termisk ydeevne, undersøgelser af mikrobielle udfordringer, vurdering af kemisk kompatibilitet og evaluering af langtidsstabilitet. Dokumenter alle test i henhold til FDA- og ISO-standarder, så de kan indsendes til myndighederne og overholde kvalitetssystemet.
Ramme for udvælgelseskriterier
Steriliseringsmetode Kompatibilitet: Match udluftningsmaterialer til specifikke steriliseringsmetoder (damp, ETO, H2O2-plasma, gamma) baseret på krav til temperatur, kemikalier og strålingsmodstand.
Specifikationer for ydeevne: Definer nødvendige flowhastigheder, trykværdier, filtreringseffektivitet og mikrobielle barriereegenskaber baseret på anvendelseskrav.
Lovmæssige krav: Overvej FDA-klassificering af udstyr, overholdelse af ISO-standarder og krav til biokompatibilitet i forbindelse med tilsigtet brug.
Parametre for vurdering af applikationer
Driftsmiljø: Evaluer temperaturintervaller, kemisk eksponering, trykforhold og kontamineringsrisici i hele produktets livscyklus.
Steriliseringsfrekvens: Overvej engangsbrug versus flere steriliseringscyklusser og kumulative effekter på materialets ydeevne og pålidelighed.
Valideringens omfang: Bestem testkrav baseret på risikovurdering, lovgivningsmæssig vej og krav til kvalitetssystemet.
Protokol for valideringstest
Test af termisk ydeevne:
- Temperaturcykling ved steriliseringsbetingelser
- Måling af dimensionel stabilitet
- Verifikation af filtreringseffektivitet efter termisk eksponering
Mikrobiel udfordringstest:
- Bakteriel udfordring med passende testorganismer
- Verifikation af vedligeholdelse af sterilitet
- Vurdering af barrierens integritet på lang sigt
Vurdering af kemisk kompatibilitet:
- Evaluering af materialenedbrydning
- Test af ekstraherbare og udvaskbare stoffer
- Verifikation af vedligeholdelse af biokompatibilitet
Krav til dokumentation
Specifikationer for materiale: Komplette materialedatablade med kemisk sammensætning, termiske egenskaber og lovpligtige certificeringer.
Testprotokoller: Detaljerede valideringsprotokoller i henhold til FDA-vejledning og ISO-standarder for steriliseringsvalidering.
Data om ydeevne: Omfattende testresultater, der viser ydeevne under alle specificerede driftsforhold og steriliseringscyklusser.
Integration af kvalitetssystemer
Kvalificering af leverandører: Etablering af kvalitetsaftaler med leverandører, herunder krav til materialesporbarhed, ændringskontrol og kvalitetsdokumentation.
Indkommende inspektion: Udvikle inspektionsprocedurer for kritiske dimensioner, materialeegenskaber og verifikation af ydeevneegenskaber.
Procesvalidering: Integrer ventilationens ydeevne i den overordnede validering af steriliseringsprocessen, herunder test af worst case-scenarier.
Overvejelser om risikostyring
Analyse af fejltilstande: Identificer potentielle fejltilstande, herunder materialenedbrydning, tætningssvigt og filtreringskompromittering med passende afhjælpningsstrategier.
Kontrol af ændringer: Fastlæg procedurer for håndtering af materialeændringer, leverandørændringer og specifikationsændringer med passende krav til revalidering.
Kontinuerlig overvågning: Implementer løbende overvågningsprogrammer for at verificere den fortsatte ydeevne og identificere potentielle problemer, før de påvirker produktkvaliteten.
Konklusion
Steriliserbare udluftningspropper spiller en afgørende rolle for at sikre effektiv sterilisering og samtidig opretholde sterile barrierer i medicinsk udstyr og farmaceutiske anvendelser. Forståelse af de unikke udfordringer ved forskellige steriliseringsmetoder og valg af passende materialer er afgørende for pålidelig ydeevne og overholdelse af lovgivningen.
PTFE-baserede udluftningspropper giver overlegen ydeevne på tværs af flere steriliseringsmetoder, hvilket giver fremragende temperaturbestandighed, kemisk kompatibilitet og langsigtet pålidelighed. Korrekt udvælgelse og validering sikrer optimal steriliseringseffektivitet og minimerer samtidig behandlingstid og omkostninger.
Hos Bepto omfatter vores omfattende sortiment af steriliserbare udluftningspropper PTFE-membraner af farmaceutisk kvalitet, valideret temperaturydelse og komplette dokumentationspakker til lovpligtige indsendelser. Med over ti års erfaring inden for specialiserede udluftningsapplikationer og ISO-certificeret produktionskapacitet leverer vi de pålidelige, omkostningseffektive løsninger, du har brug for til kritiske steriliseringsapplikationer. Stol på, at vi holder dine steriliseringsprocesser validerede og dine produkter sikre! 🔬
Ofte stillede spørgsmål om steriliserbare udluftningspropper
Q: Kan den samme udluftningsprop bruges til både autoklave- og ETO-sterilisering?
A: Ja, PTFE-membranudluftningspropper kan håndtere både autoklave- og ETO-sterilisering effektivt. PTFE giver fremragende temperaturbestandighed til autoklavecyklusser og minimal ETO-absorption til hurtig udluftning, hvilket gør det ideelt til faciliteter, der bruger flere steriliseringsmetoder.
Q: Hvor mange sterilisationscyklusser kan en udluftningsprop tåle?
A: PTFE-udluftningspropper af høj kvalitet kan typisk modstå 100+ autoklavecyklusser eller 50+ ETO-cyklusser og samtidig bevare filtreringsydelsen. Den faktiske cykluslevetid afhænger af steriliseringsparametre, håndteringsprocedurer og kriterier for accept af ydeevne for din specifikke anvendelse.
Spørgsmål: Hvilken porestørrelse kræves til sterilfiltrering i medicinske applikationer?
A: Medicinske anvendelser kræver typisk porestørrelser på 0,2 eller 0,22 mikron for pålidelig tilbageholdelse af bakterier. Denne porestørrelse giver valideret sterilitetssikring, samtidig med at den tillader tilstrækkeligt gasflow til effektiv sterilisering og trykudligning.
Spørgsmål: Kræver steriliserbare udluftningspropper særlige valideringstest?
A: Ja, steriliserbare udluftningspropper kræver valideringstest, herunder termisk ydeevne, mikrobiel udfordring og undersøgelser af materialekompatibilitet. Testen skal følge FDA's retningslinjer og ISO-standarder, og dokumentationen skal understøtte valideringen af din steriliseringsproces og de lovpligtige indsendelser.
Q: Hvordan forhindrer man kontaminering af udluftningspropper under sterilisering?
A: Forebyg kontaminering gennem korrekt installation, beskyttelsesdæksler under håndtering, validerede steriliseringsparametre og passende opbevaring efter sterilisering. Brug steril teknik under installationen, og sørg for, at udluftningspropperne er designet til din specifikke steriliseringsmetode og dine anvendelseskrav.
-
Lær de videnskabelige principper for autoklavesterilisering, og hvordan mættet damp under tryk bruges til effektivt at dræbe mikroorganismer. ↩
-
Udforsk den kemiske proces ved sterilisering med ethylenoxid (ETO), en lavtemperaturmetode, der bruges til at sterilisere varme- og fugtfølsomt medicinsk udstyr. ↩
-
Opdag de metoder, der bruges til at teste og validere effektiviteten af en mikrobiel barriere og sikre, at den forhindrer indtrængen af mikroorganismer og opretholder steriliteten. ↩
-
Gennemgå de vigtigste krav i ISO 11607-standarden, som specificerer materialer og test til sterile barrieresystemer til medicinsk udstyr. ↩
-
Forstå den kemiske reaktion hydrolyse, og hvordan den kan forårsage nedbrydning af visse polymermaterialer, når de udsættes for vand eller damp ved høje temperaturer. ↩



